Содержание
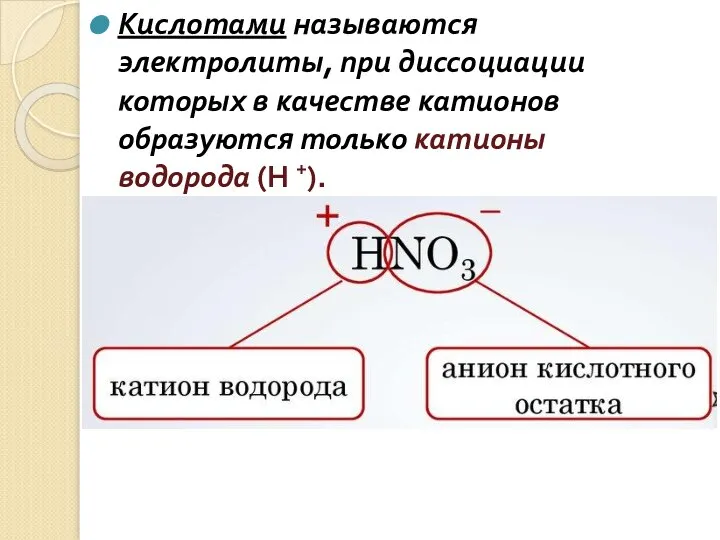
- 2. Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H +).
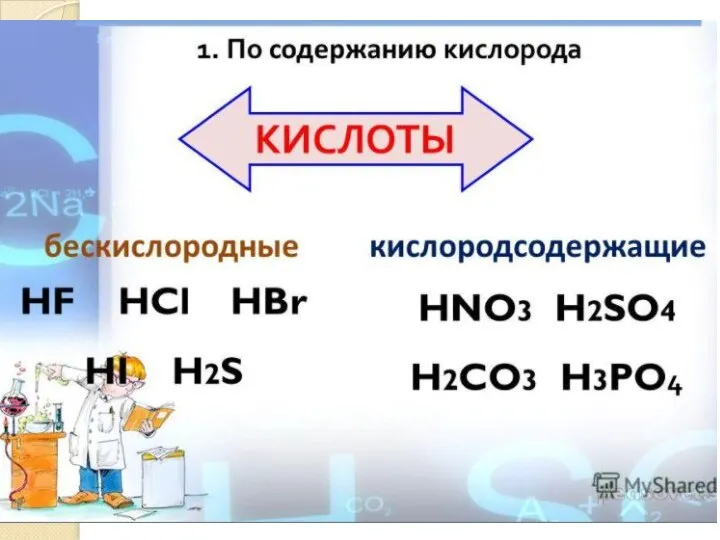
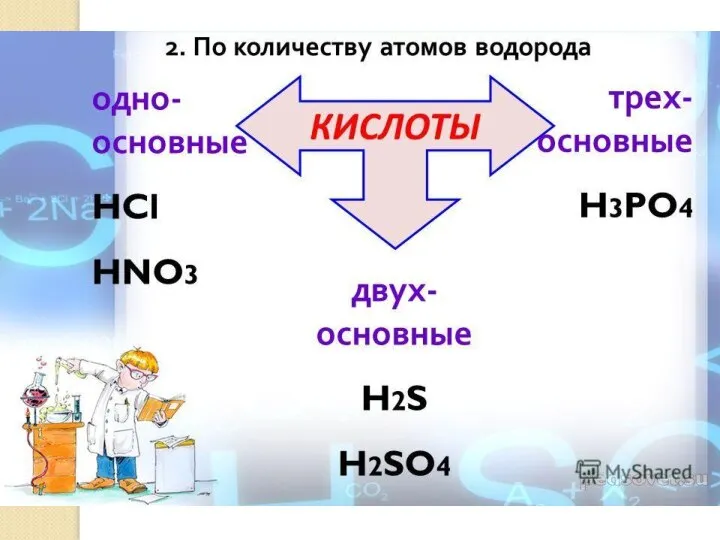
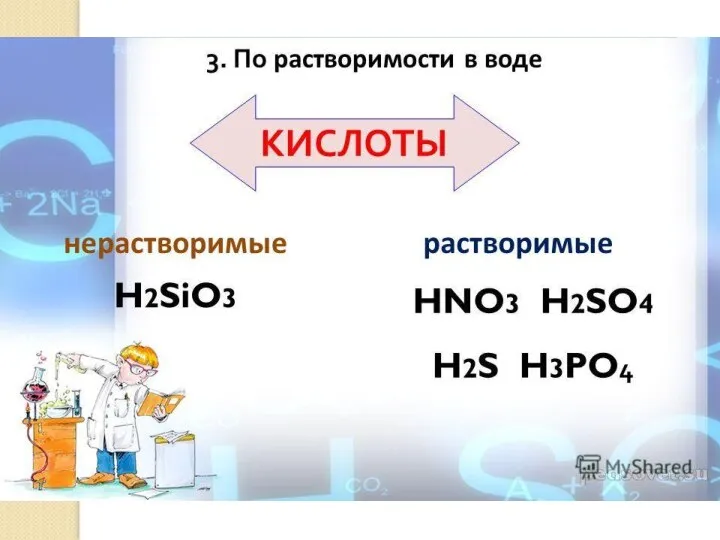
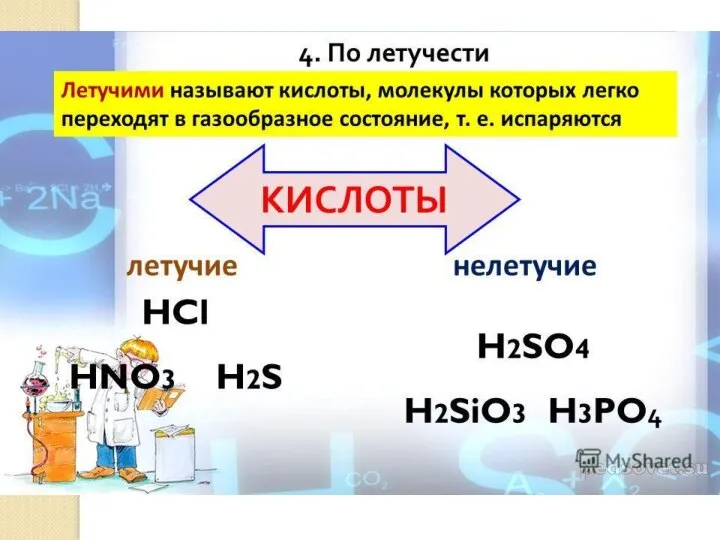
- 4. Классификация кислот по различным признакам По какому признаку кислоты разделены на группы? HNO3 - азотная HNO2
- 6. По какому признаку кислоты разделены на группы. HF - фтороводородная HCl - хлороводородная HBr - бромоводородная
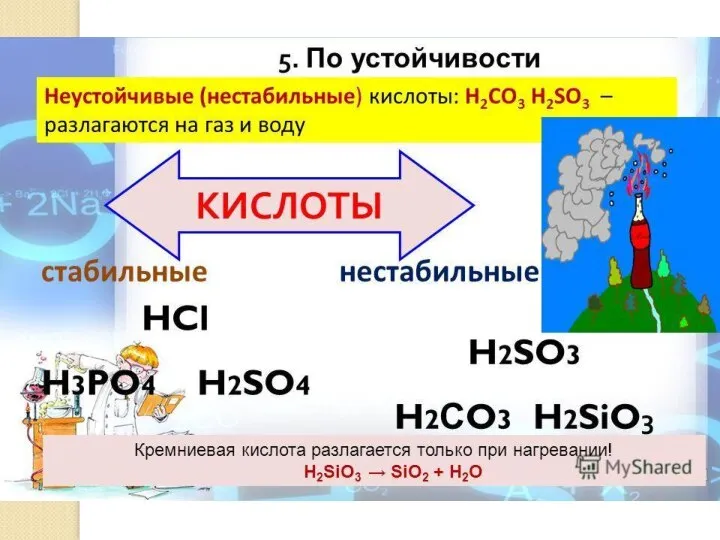
- 11. КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ 6. По степени диссоциации
- 16. Особенности взаимодействия азотной кислоты с металлами Азотная кислота HNO3 любой концентрации — сильный окислитель. Окислительные свойства
- 17. Концентрированная азотная кислота не взаимодействует с Au, Pt . Концентрированная азотная кислота на холоде не взаимодействует
- 18. Особенности взаимодействия концентрированной серной кислоты с металлами Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей
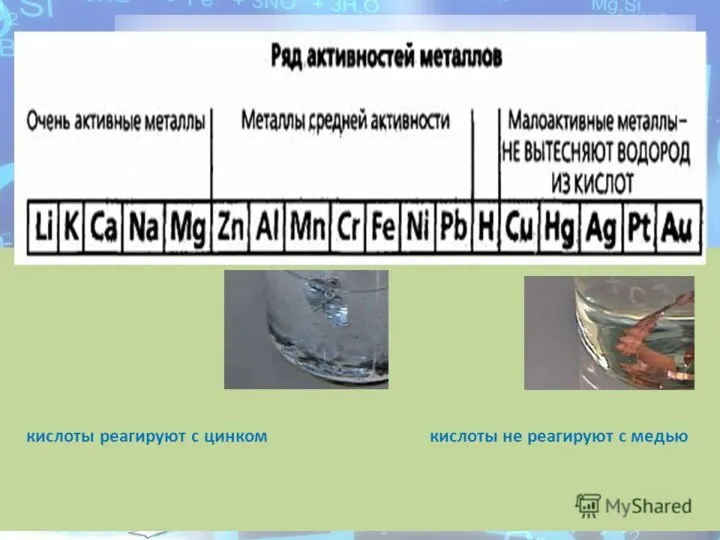
- 19. Серная кислота смешивается с водой и SO3, во всех соотношениях. Разбавленная серная кислота реагирует с активными
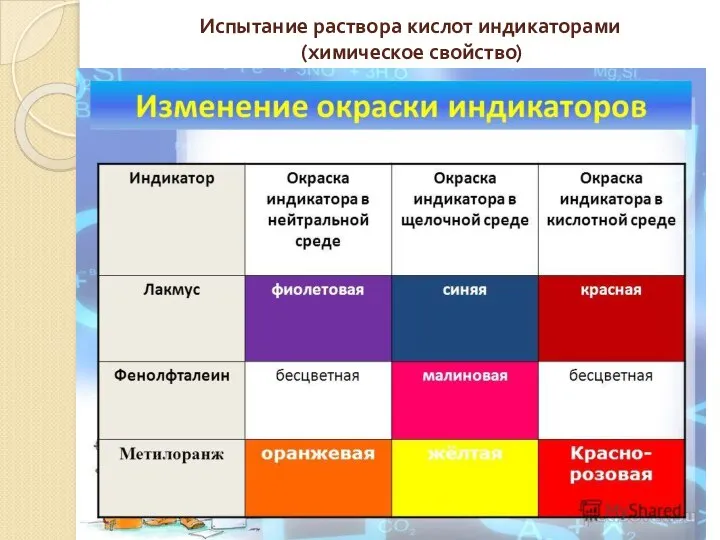
- 23. Испытание раствора кислот индикаторами (химическое свойство)
- 25. Скачать презентацию














 Фараонова Змея
Фараонова Змея Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли
Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли Презентация на тему Химия в разных науках
Презентация на тему Химия в разных науках  Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль
Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль Типы химических реакций. 8 класс
Типы химических реакций. 8 класс Фенол. Понятие о фенолах
Фенол. Понятие о фенолах Исследование свойств многоатомных спиртов
Исследование свойств многоатомных спиртов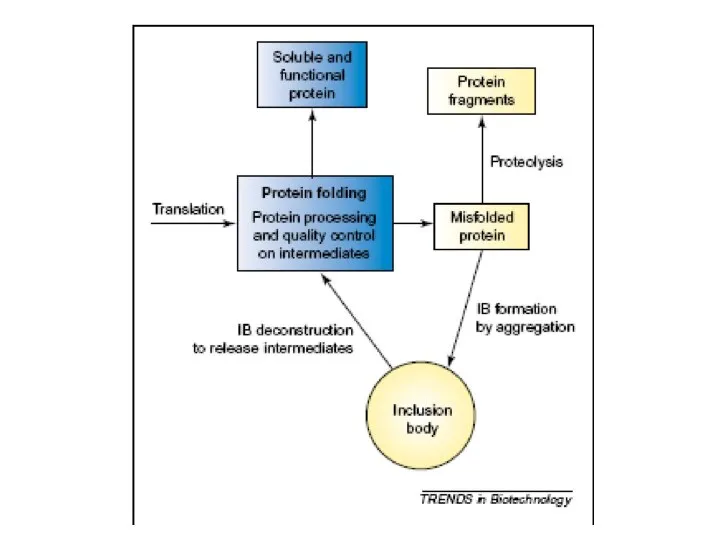 Рефолдинг миниантител
Рефолдинг миниантител Презентация на тему Электролитическая диссоциация (8 класс)
Презентация на тему Электролитическая диссоциация (8 класс)  Комплексные соединения
Комплексные соединения Развитие ассоциативного мышления на уроках химии
Развитие ассоциативного мышления на уроках химии Презентация на тему Валентные состояния атома углерода
Презентация на тему Валентные состояния атома углерода  Медь
Медь Презентация по Химии "Белки как основа всего живого"
Презентация по Химии "Белки как основа всего живого"  Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3 Предмет органической химии. Урок №1
Предмет органической химии. Урок №1 Удельная теплота сгорания
Удельная теплота сгорания Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Презентация на тему Неорганические кислоты
Презентация на тему Неорганические кислоты  Выберите вещества
Выберите вещества Автомобильное дизельное топливо
Автомобильное дизельное топливо Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю Презентация на тему Элементы главной подгруппы V группы
Презентация на тему Элементы главной подгруппы V группы  Элементарный, химический и фракционный состав нефти, газа и конденсата
Элементарный, химический и фракционный состав нефти, газа и конденсата Химические уравнения
Химические уравнения Вчення про розчини. Колігативні властивості розчинів
Вчення про розчини. Колігативні властивості розчинів Пластмассы и их свойства
Пластмассы и их свойства