Содержание
- 2. Введение Известно, что одни химические реакции протекают очень быстро, другие – за значительные промежутки времени. При
- 3. Понятие о скорости реакции С огромными скоростями протекают реакции, сопровождающиеся взрывами
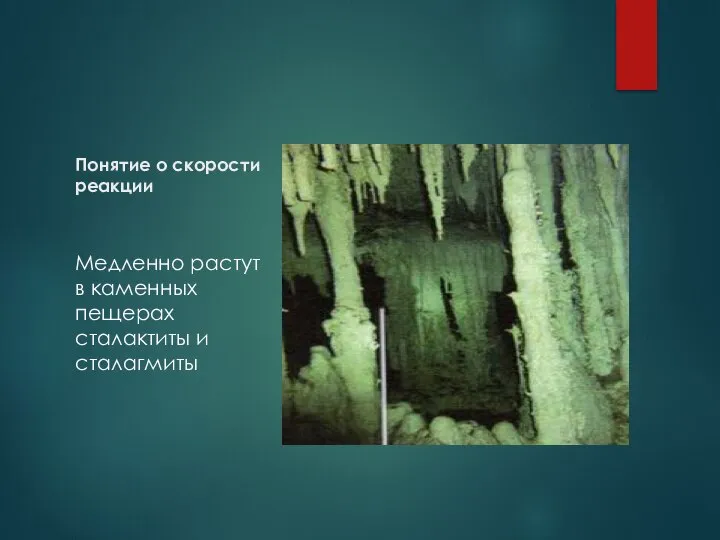
- 4. Понятие о скорости реакции Медленно растут в каменных пещерах сталактиты и сталагмиты
- 5. Понятие о скорости реакции Медленно корродируют (ржавеют) стальные изделия
- 6. Понятие о скорости реакции Медленно разрушаются под действием кислотных дождей дворцы и статуи
- 7. Понятие о скорости химической реакции Под скоростью химической реакции понимают изменение концентрации реагирующих веществ в единицу
- 8. Факторы влияющие на скорость химической реакции Природа реагирующих веществ. Концентрация реагирующих веществ. Площадь соприкосновения реагирующих веществ.
- 9. Вывод: Чем выше концентрация реагирующих веществ, тем выше и скорость взаимодействия между ними. Концентрацию газообразных веществ
- 10. Вывод: (для гетерогенных реакций) чем больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции. В этом
- 11. Вывод: чем выше температура, тем больше скорость реакции. Первый лауреат Нобелевской премии голландский химик Я. Х.
- 12. Вант-Гофф Якоб Хендрик (1852-1911)
- 13. Высокотемпературные химические процессы Варка стекла
- 14. Высокотемпературные химические процессы Выплавка чугуна
- 15. Высокотемпературные химические процессы Производство нефтепродуктов
- 16. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 17. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока
- 18. Химическое равновесие — состояние химической реакции, при котором количества исходных веществ и продуктов не меняются со
- 19. Состав равновесной смеси, состоящей из реагентов и продуктов, зависит от условий. Если в смеси продуктов больше,
- 20. Принцип Ле-Шателье Общий принцип смещения химического равновесия был предложен французским ученым Анри Ле-Шателье. Общий принцип смещения
- 21. Факторы, влияющие на смещение химического равновесия Концентрация При увеличении концентрации одного из веществ в системе химической
- 22. Пример N2+3H2 2NH3 + 91,84 кДж При увеличении концентрации газообразного азота в системе, возрастет и его
- 23. Температура При повышении температуры (нагревании системы) равновесие сдвигается в сторону эндотермической реакции, при понижении температуры (охлаждении
- 24. Пример N2+3H2 2NH3 + 91,84 кДж При повышении температуры прямая экзотермическая реакция будет замедляться и равновесие
- 25. Давление Давление влияет только на обратимые газовые реакции, причем только на те из них, в которых
- 26. Пример N2+3H2 2NH3 + 91,84 кДж Количество газов в левой части уравнения (1+3)=4 моль, в правой
- 27. Катализатор При использовании катализатора в равновесных системах, ускоряются как прямая, так и обратная реакции, причем скорости
- 29. Скачать презентацию

























 Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии nukleinovye_kisloty
nukleinovye_kisloty Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Презентация 1
Презентация 1 Гравиметрический анализ. Лекция 1
Гравиметрический анализ. Лекция 1 Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Урок химии на дне океана. Задача 13
Урок химии на дне океана. Задача 13 Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Электролитическая диссоциация. Урок химии в 8 классе
Электролитическая диссоциация. Урок химии в 8 классе Алканы. Строение и изомерия
Алканы. Строение и изомерия Реакционная система. Схема химической реакции. Закон сохранения массы веществ в химической реакции
Реакционная система. Схема химической реакции. Закон сохранения массы веществ в химической реакции Великие ученые общей и неорганической химии
Великие ученые общей и неорганической химии Химические свойства кислот
Химические свойства кислот Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики
Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики Комплексные соединения
Комплексные соединения Решение экспериментальных задач. Практическая работа №5
Решение экспериментальных задач. Практическая работа №5 Классификация реакций. Таблица
Классификация реакций. Таблица способы разделения смесей
способы разделения смесей Решение задач на смеси, растворы и сплавы
Решение задач на смеси, растворы и сплавы Модельные представления силикатных структур
Модельные представления силикатных структур Карбоновые кислоты
Карбоновые кислоты Способы получения металлов
Способы получения металлов Закономерности изменения свойств атомов химических элементов
Закономерности изменения свойств атомов химических элементов Хроматография
Хроматография Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Физические и химические явления 8 класс Учитель химии Кузнецова А.Н.
Физические и химические явления 8 класс Учитель химии Кузнецова А.Н. АЛКЕНЫ-10
АЛКЕНЫ-10 Общая характеристика галогенов на основе положения химических элементов в периодической системе
Общая характеристика галогенов на основе положения химических элементов в периодической системе