Содержание
- 2. Одна з найважливіших особливостей хімічних реакцій полягає в тому, що їх протікання супроводжується зміною енергії Чому?
- 3. Деякі поняття хімічної термодинаміки
- 4. Системою називають умовно виділені з оточуючого середовища окреме тіло або групу тіл, які взаємодіють між собою
- 5. Систему називають ізольованою, якщо між нею і оточуючим середовищем не відбувається обміну речовинами та енергією (відсутній
- 6. Якщо між системою і зовнішнім середовищем можливий і масо- і теплообмін, систему називають відкритою Стан системи
- 7. Властивості поділяються на інтенсивні (температура, тиск, концентрація та ін.), якими характеризується кожна частина системи, та екстенсивні,
- 8. Теплові ефекти Внутрішня енергія й ентальпія Хімічні реакції відбуваються з виділенням або поглинанням енергії. Енергетичні ефекти
- 9. Pеакції 2Cu(NO3)2 → 2CuO + 4NO2 + O2 CH4 +H2O → CO + 3H2 протікають з
- 10. Робота гальванічного елемента або акумулятора є прикладом виділення електричної енергії внаслідок перебігу хімічної реакції, а процеси
- 11. Відомо, що хімічні перетворення — це руйнування хімічних зв'язків між атомами в вихідних речовинах, замість яких
- 12. Слід зазначити, що на тепловий ефект реакції впливає також зміна енергії міжмолекулярної взаємодії, а отже агрегатний
- 13. Внутрішня енергія системи U — це термодинамічна функція, яка включає в себе всі види енергії (енергію
- 14. Абсолютну величину внутрішньої енергії неможливо визначити, можна тільки визначити її зміну, тобто різницю між кінцевим і
- 15. Відповідно до закону збереження енергії, який називають першим законом термодинаміки, значення внутрішньої енергії U залишається сталим,
- 16. Розглянемо систему, що представляє собою газ, який знаходиться у циліндрі, закритому поршнем. Якщо поршень закріпити нерухомо,
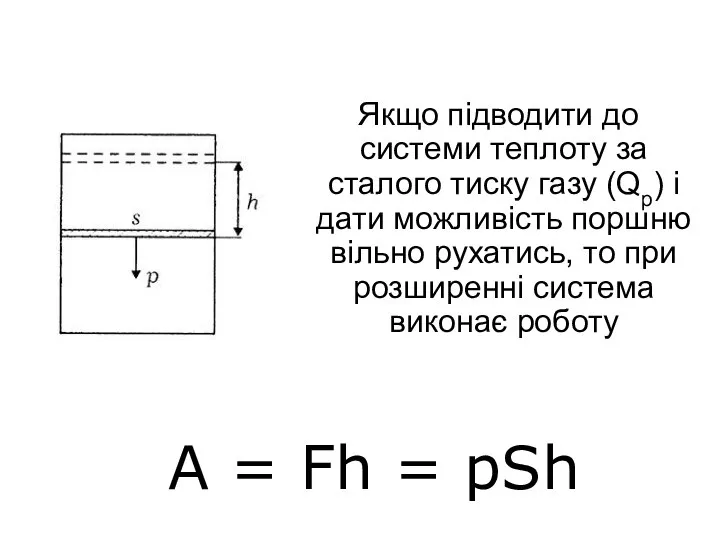
- 17. Якщо підводити до системи теплоту за сталого тиску газу (Qp) і дати можливість поршню вільно рухатись,
- 18. де F — сила, що діє на поршень; h — висота переміщення поршня; р — тиск;
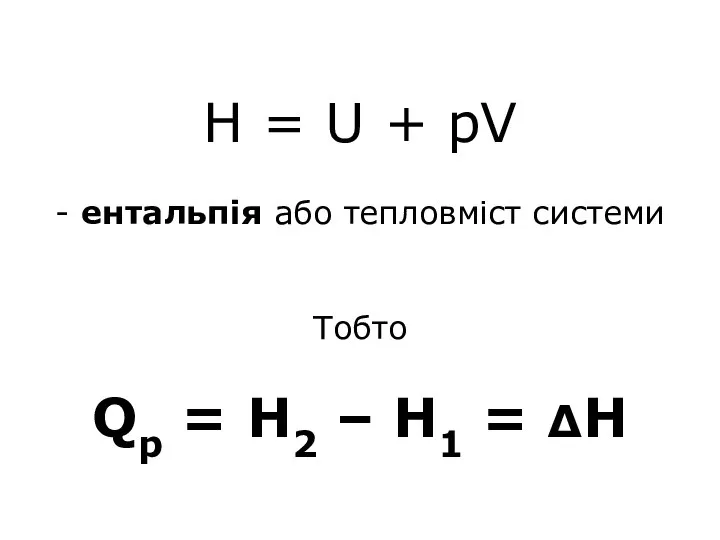
- 19. Н = U + pV - ентальпія або тепловміст системи Тобто Qp = Н2 – Н1
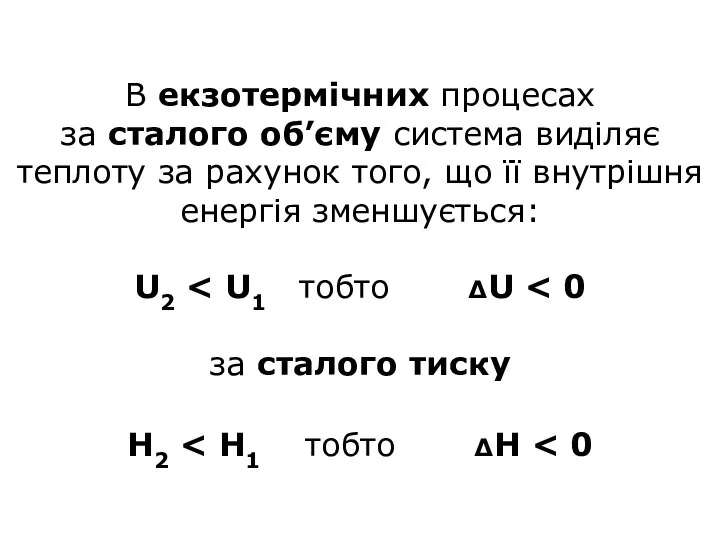
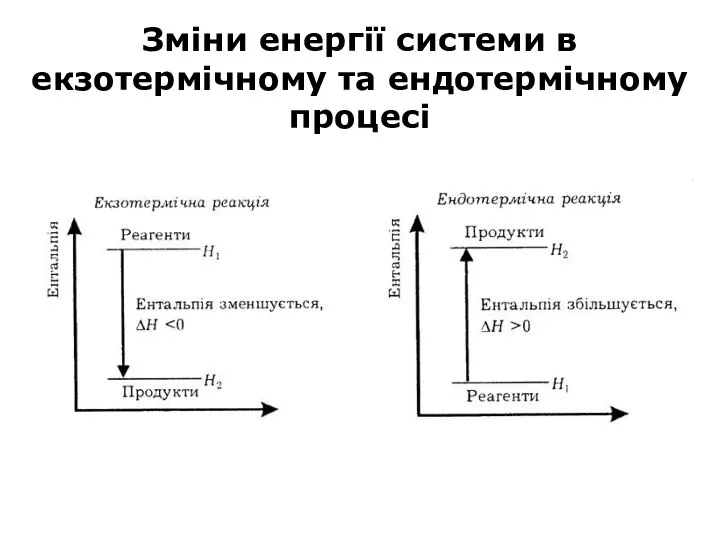
- 20. В екзотермічних процесах за сталого об’єму система виділяє теплоту за рахунок того, що її внутрішня енергія
- 21. В ендотермічних процесах система вбирає теплоту, запас її енергії зростає : U2 > U1 ΔU >
- 22. Зміни енергії системи в екзотермічному та ендотермічному процесі
- 23. Термохімічні рівняння Рівняння хімічних реакцій, в яких наводяться агрегатні стани речовин та тепловий ефект реакції, називають
- 24. Теплові ефекти залежать від агрегатного стану речовин і умов, в яких відбувається реакція, тому в термохімічних
- 25. 2 Н2 (г) + О2 (г) → 2 Н20 (р) ΔН0 = -571,66 кДж тепловий ефект,
- 26. Якщо коефіцієнти скоротити на 2, відповідно зменшується і значення ΔН0: Н2 (г) + 1/2 О2 (г)
- 27. У випадку, коли агрегатні стани наперед відомі, індекси “газ”, “рідина”, “кристалічна речовина” досить часто випускають
- 28. Закони термохімії Перший закон термохімії сформулювали А.Л.Лавуаз'є та П.С.Лаплас: Теплота розкладу даної сполуки чисельно дорівнює теплоті
- 29. Таким чином, якщо при одержанні з кисню та водню 1 моля рідкої води виділяється 285,83 кДж
- 30. Другий закон термохімії в 1840 p. відкрив російській хімік Г.І.Гесс: Тепловий ефект хімічної реакції залежіть від
- 31. Суть закону Гесса може бути показана на прикладі реакції графіту з киснем, яка може перебігати двома
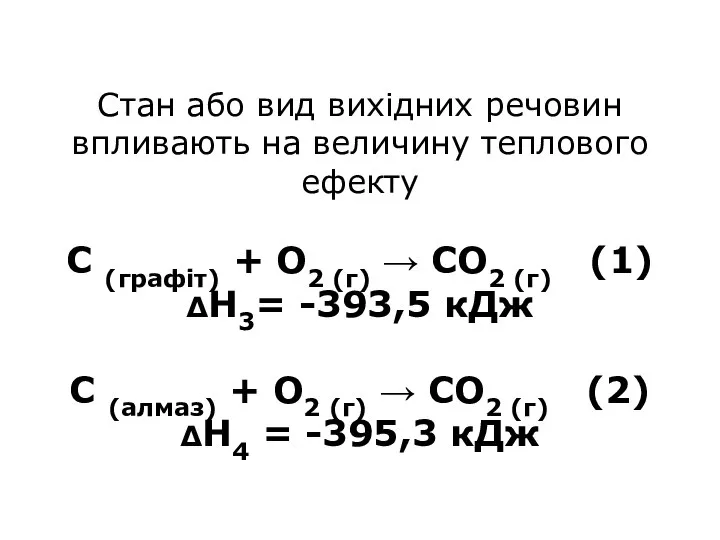
- 32. Другий шлях: С (графіт) + О2 (г) → СО2 (г) , ΔН3 = -393,5 кДж ΔН3
- 33. Наслідки закону Гесса: 1.Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів проміжних стадій. 2.Термохімічні рівняння можна
- 34. Стан або вид вихідних речовин впливають на величину теплового ефекту С (графіт) + О2 (г) →
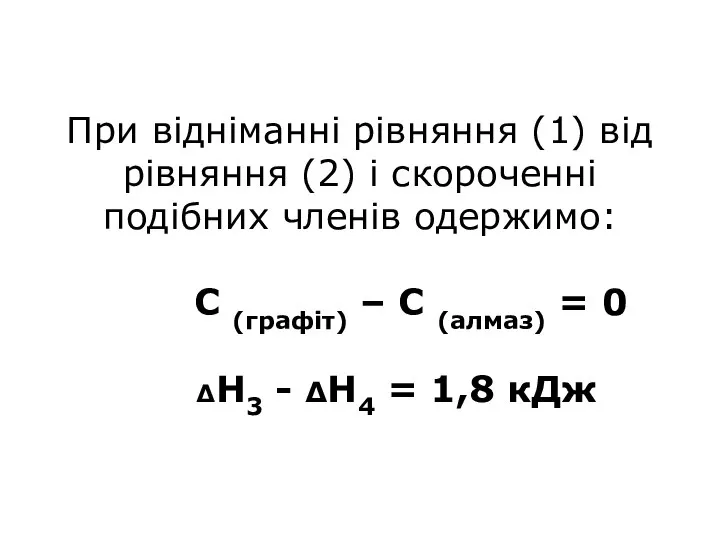
- 35. При відніманні рівняння (1) від рівняння (2) і скороченні подібних членів одержимо: С (графіт) – С
- 36. Таким чином різниця теплових ефектів реакцій (1) і (2) дорівнює тепловому ефекту переходу від одного стану
- 37. 3. Якщо в двох реакціях з різних вихідних речовин утворюються однакові продукти, то різниця теплових ефектів
- 38. Найчастіше використовують метод циклів, який полягає у тому, що реакцію з тепловим ефектом, який треба визначити,
- 39. Метод циклів лежить в основі обчислення теплових ефектів реакцій через теплоти утворення речовин Hf (f —
- 40. Так, теплотами утворення Н2О та СаСОз є ΔН таких реакцій: Н2 (г) + 1/2 О2 (г)
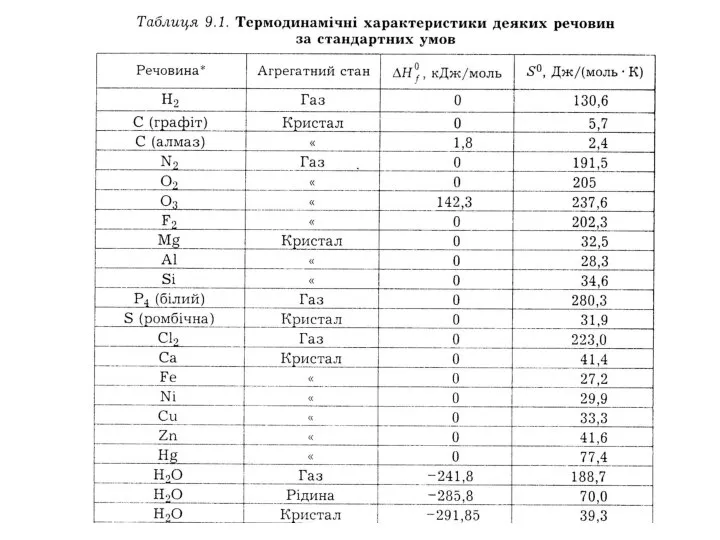
- 41. Теплоти утворення простих речовин, стійких за стандартних умов, приймають рівними нулю Значення теплот утворення наводять у
- 43. Не всі ці значення виміряні експериментально, багато з них обчислені за значеннями ΔН інших реакцій. Якщо
- 44. Навпаки, якщо ΔНfo має позитивне значення, ця речовина звичайно є нестійкою і розкладається на прості речовини
- 45. Якщо якась проста речовина є нестійкою за стандартних умов, для неї наводиться значення ΔHf, що дорівнює
- 46. 4. Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот
- 47. Для органічних речовин теплові ефекти реакцій часто знаходять за теплотами згоряння речовин, які досить легко можна
- 48. Тепловий ефект реакції дорівнює різниці між сумою теплот згоряння вихідних речовин і сумою теплот згоряння продуктів
- 49. Напрямленість процесів Ентропія Ізобарно-ізотермічний потенціал
- 50. Нейтралізація кислоти основою, згоряння палива, іржавіння цвяха, перехід речовини з аморфного стану в кристалічний, падіння каменя
- 51. Кінцевий стан системи має меншу енергію, ніж вихідний, тому що стан з меншою енергією є більш
- 52. Дійсно, за звичайних умов більшість самочинних процесів є екзотермічними, але тенденція до досягнення мінімальної енергії не
- 53. Розглянемо деякі явища, які не супроводжуються помітним тепловим ефектом, щоб визначити інший фактор, окрім енергетичного, від
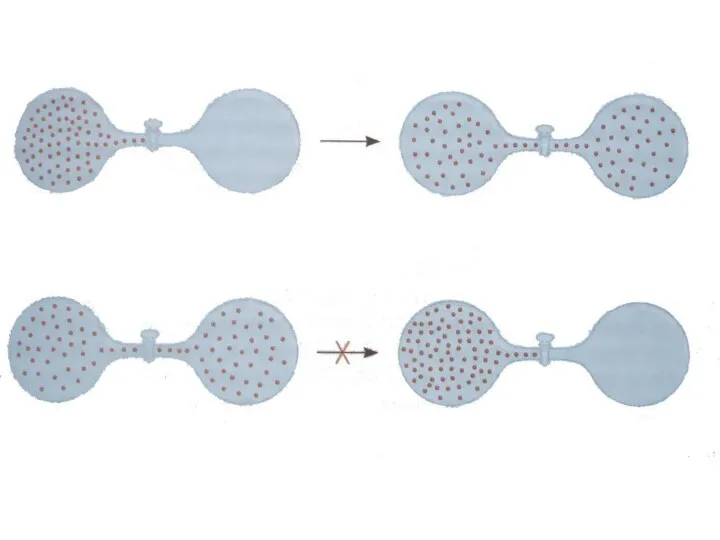
- 54. Яким же чинником визначається напрямок процесу змішування газів або розподілу газу чи розчиненої речовини у всьому
- 56. У кожному випадку кінцевий стан системи характеризується більшою хаотичністю, невпорядкованістю порівняно з вихідним станом. Мірою невпорядкованості
- 57. Другий закон термодинаміки В ізольованих системах відбуваються тільки ті процеси, що приводять до росту ентропії :
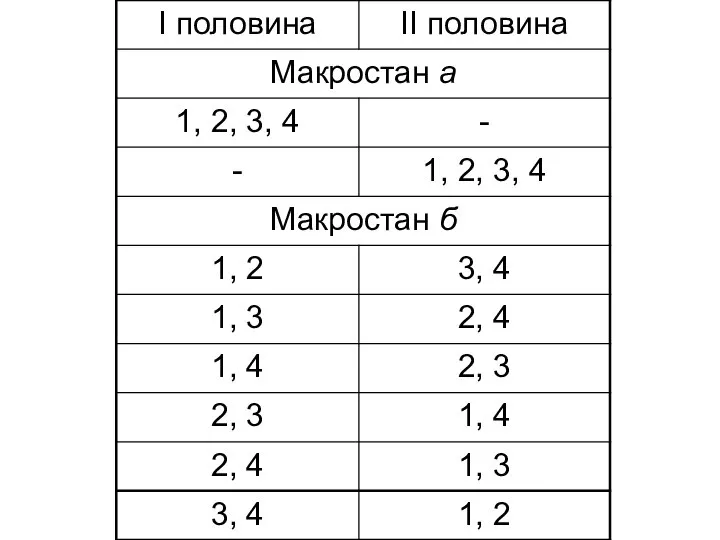
- 58. Хаотичність або невпорядкованість системи може бути охарактеризована термодинамічною ймовірністю. Термодинамічна ймовірність ω — це кількість мікростанів
- 60. Зв'язок між ентропією системи і термодинамічною ймовірністю виражається рівнянням Л. Больцмана S = k ln ω
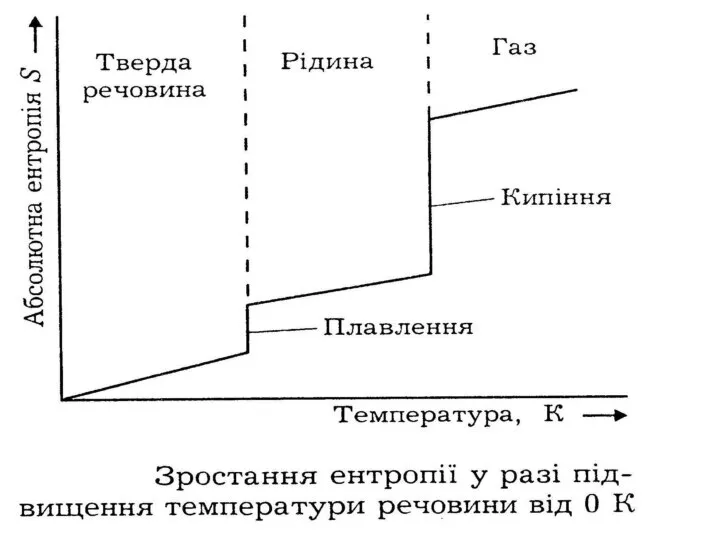
- 61. В ідеальному кристалі за Т = 0 К (температура абсолютного нуля) рух атомів відсутній, атоми знаходяться
- 62. Для практичного обчислення значень ентропій речовин рівняння Больцмана не застосовують, оскільки дуже важко обчислити і неможливо
- 63. Подальше зростання ентропії при нагріванні пов'язане з посиленням теплового руху частинок, тобто з кількістю підведеної до
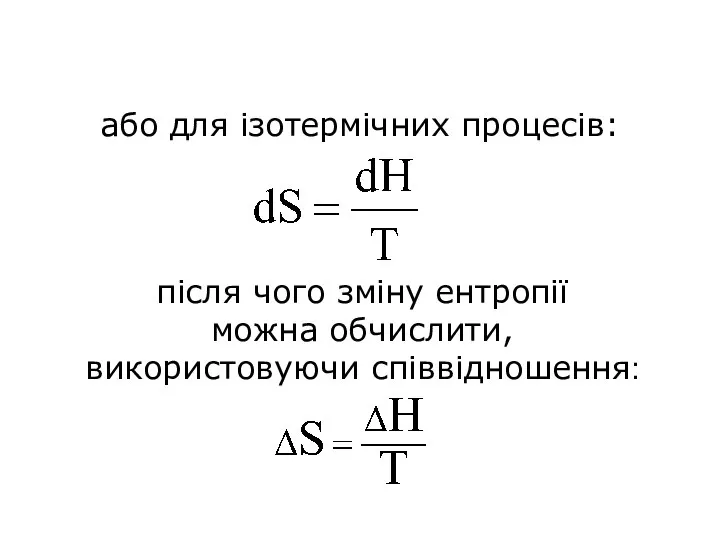
- 64. або для ізотермічних процесів: після чого зміну ентропії можна обчислити, використовуючи співвідношення:
- 66. Значення S для 1 моля речовини називають стандартними ентропіями S0 і наводять у довідниках. Значення ентропії
- 67. Ентропія речовини у аморфному стані завжди більша, ніж у кристалічному. При ускладненні молекулярної формули речовини ентропія
- 68. Аналогічна закономірність спостерігається для ряду вуглеводнів. Так, для газоподібних сполук СН4, С2Н2, С2Н4, і C2H6 значення
- 69. Разом з тим треба мати на увазі, що в реакціях розкладу речовин з утворенням декількох більш
- 70. Наприклад, в реакції розкладу молекулярного кисню на атомарний кисень (О2 → 2О) ентропія зростає від 205
- 71. Зміна ентропії при перебігу хімічних реакцій (ентропія реакції) дорівнює різниці між сумою ентропій продуктів реакції і
- 72. В багатьох випадках знак ΔS можна оцінити якісно, не вдаючись до обчислень, порівнявши кількість частинок, а
- 73. Таким чином для самочинних процесів ΔН 0 Ентальпійний і ентропійний фактори діють незалежно один від одного
- 74. За своїм фізичним змістом ізобарно-ізотермічний потенціал – це здатність системи виконувати корисну роботу Максимальна величина корисної
- 75. Енергетичний ефект хімічної реакції (ΔH) або іншого процесу можна розглядати як суму двох складових, перша з
- 76. Зміна вільної енергії в процесах, що проходять за сталих тиску і температури визначається виразом: ΔG =
- 77. Функція G за своїм фізичним змістом показує здатність системи виконувати корисну роботу. У самочинних процесах ця
- 78. Якщо ΔG > 0, це означає, що процес в прямому напрямку самочинно проходити не може: щоб
- 79. Абсолютні значення вільної енергії, як і значення її складової — ентальпії невідомі. Можна обчислити за рівнянням
- 80. За низьких температур, навпаки, член -TΔS має невеликі значення, ΔG ≈ ΔН. лід ⇆ вода ΔН
- 81. Виходячи з того, що ΔН > 0, можна зробити висновок, що ΔG також більше нуля, тому
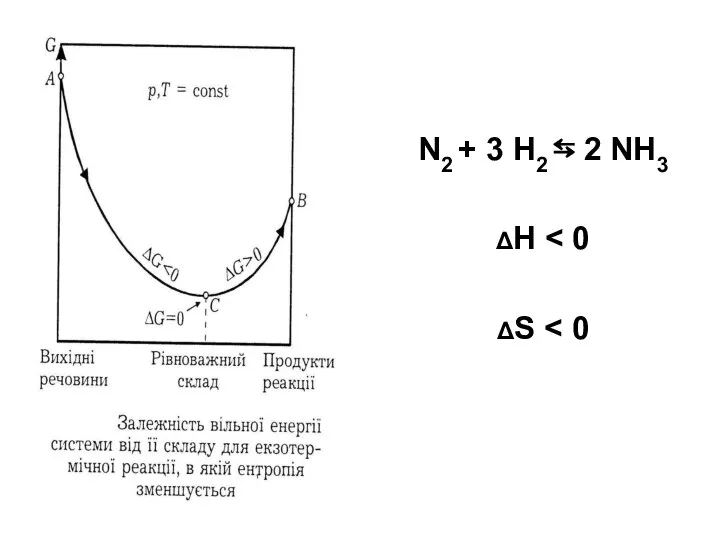
- 82. N2 + 3 Н2 ⇆ 2 NH3 ΔН ΔS
- 83. За низьких температур ΔG ≈ ΔН 0, оскільки ΔS має від'ємні значення, процес протікає самочинно в
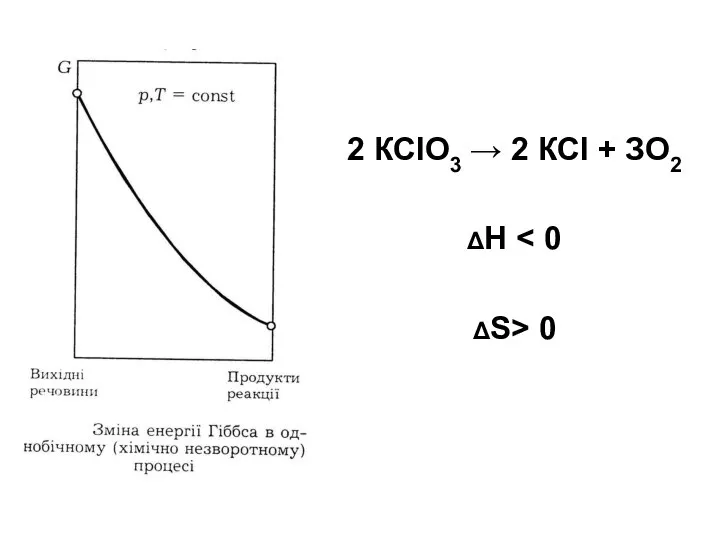
- 84. 2 КСlO3 → 2 КСl + ЗО2 ΔН ΔS> 0
- 86. Скачать презентацию















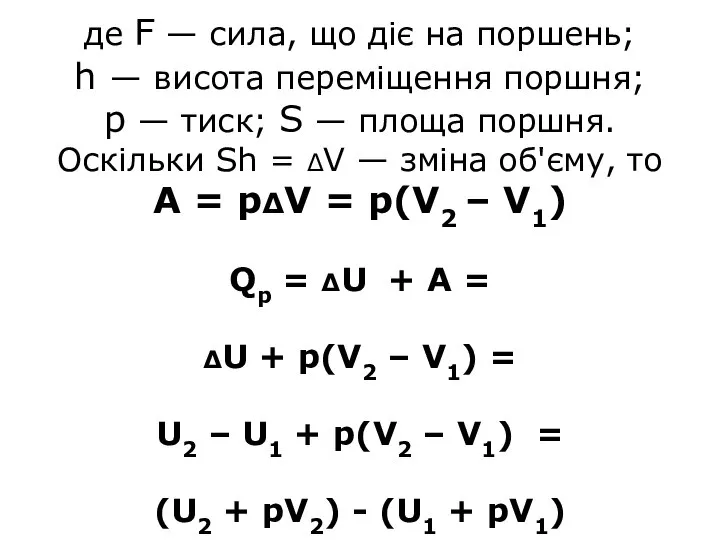





















































 Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Решение задач по химическим уравнениям
Решение задач по химическим уравнениям Предмет органической химии
Предмет органической химии Соли. Формула соли
Соли. Формула соли Радиоакивные металлы
Радиоакивные металлы Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Цезий
Цезий Физическая химия растворов электролитов
Физическая химия растворов электролитов Строение вещества. Химическая связь
Строение вещества. Химическая связь Введение в практическую деятельность
Введение в практическую деятельность Изучение свойств пластичных масс для лепки
Изучение свойств пластичных масс для лепки Алкены
Алкены Вклад учёных-химиков в Великую победу
Вклад учёных-химиков в Великую победу Соль. Добыча соли
Соль. Добыча соли Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Indikatori. R. Boila eksperiments
Indikatori. R. Boila eksperiments Вода. Общие сведения
Вода. Общие сведения Презентация на тему Гормоны
Презентация на тему Гормоны  Жиры
Жиры Красители для волос. Первая группа
Красители для волос. Первая группа Пероксид водорода
Пероксид водорода Введение в органическую химию
Введение в органическую химию Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Циклические эфиры (окиси)
Циклические эфиры (окиси) Спирты
Спирты Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год
Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год Основания, их классификация и свойства
Основания, их классификация и свойства Коррозия металлов и ГЭ
Коррозия металлов и ГЭ