Содержание
- 2. Физические свойства По агрегатному состоянию: Газообразные (HCl, НВr, H2S) Жидкие (HNO3, H2SO4) Твердые (H3PO4, H2SiO3) Цвет
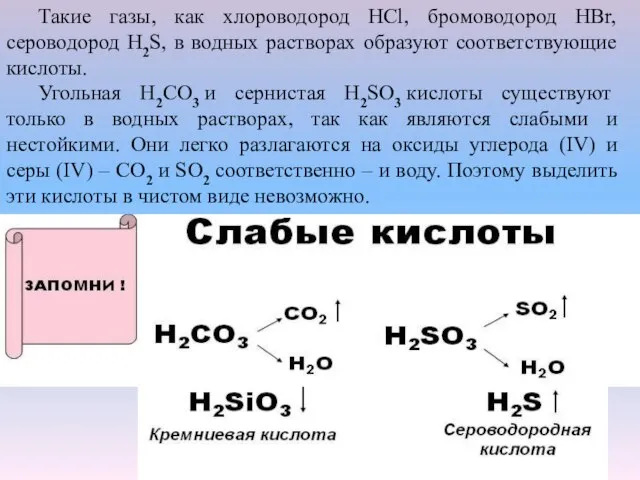
- 3. Такие газы, как хлороводород НСl, бромоводород НВr, сероводород H2S, в водных растворах образуют соответствующие кислоты. Угольная
- 4. Химические свойства Первая реакция протекает между любыми кислотами и основаниями (как с растворимыми, так и с
- 5. Химические свойства Вторая реакция протекает между оксидами металлов и большинством кислот, например: H2SO4 + FeO =
- 6. Химические свойства Чтобы прошла третья реакция, необходимо выполнить несколько условий: 1) Металл должен находиться в ряду
- 7. 3) Реакция характерна для растворов кислот, поэтому нерастворимые кислоты, например кремниевая, не вступают в реакции с
- 8. Химические свойства Четвёртая реакция – типичная реакция ионного обмена, протекающая только в случае, если образуется:
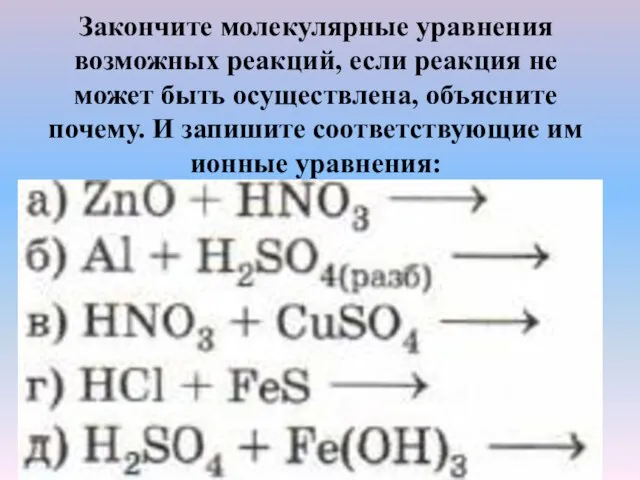
- 9. Закончите молекулярные уравнения возможных реакций, если реакция не может быть осуществлена, объясните почему. И запишите соответствующие
- 11. Скачать презентацию






 Лекция 6 Смазочные масла
Лекция 6 Смазочные масла Презентация на тему Моющие средства
Презентация на тему Моющие средства  Презентация на тему Соединения химических элементов
Презентация на тему Соединения химических элементов  Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Лекция 3. Строение электронной оболочки атома (1)
Лекция 3. Строение электронной оболочки атома (1) Презентация на тему Химические вещества: строительные и поделочные материалы
Презентация на тему Химические вещества: строительные и поделочные материалы  Реакции по направлению процесса
Реакции по направлению процесса Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2)
Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2) Конкурс юных химиков
Конкурс юных химиков Химические уравнения
Химические уравнения Металлы. Общая характеристика, химические свойства. Получение
Металлы. Общая характеристика, химические свойства. Получение Кислород и озон
Кислород и озон Урок №10 12 класс
Урок №10 12 класс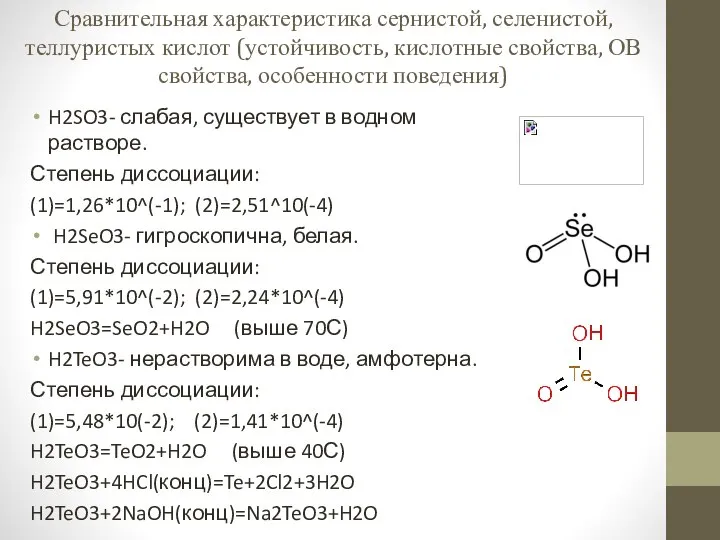 Сравнительная характеристика сернистой, селенистой, теллуристых кислот
Сравнительная характеристика сернистой, селенистой, теллуристых кислот Заполни электронные уровни элементов
Заполни электронные уровни элементов Углеводороды: изомерия
Углеводороды: изомерия Олово
Олово Альдегиды и кетоны
Альдегиды и кетоны Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Различные типы неорганических полимеров
Различные типы неорганических полимеров Водород. Вода
Водород. Вода Аналитическая химия (ЛЕКЦИЯ 1)
Аналитическая химия (ЛЕКЦИЯ 1) Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева Растворы. Лекция 7
Растворы. Лекция 7 Биоорганическая химия
Биоорганическая химия Производные углеводородов
Производные углеводородов Алкены
Алкены