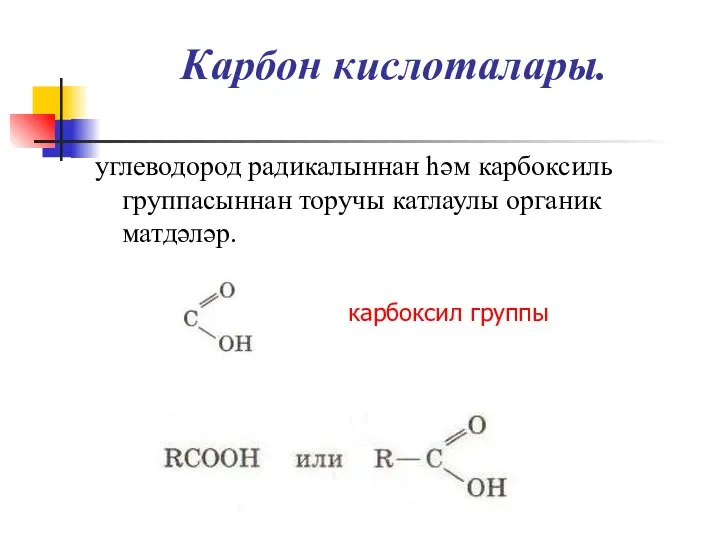
Слайд 3Карбон кислоталары.
углеводород радикалыннан һәм карбоксиль группасыннан торучы катлаулы органик матдәләр.
карбоксил группы
Слайд 4Гомуми формуласы
Сn Н2n + 1 СООН
Слайд 5Гомологик рәте һәм номенклатурасы
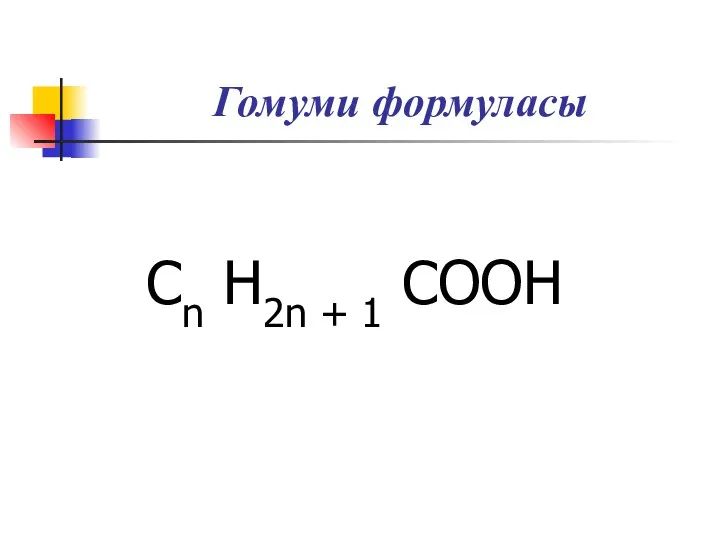
Н-
метановая
(муравьиная) кислота
СН3-
этановая (уксусная) кислота
СН3-СН2-
Пропановая
(пропионовая) кислота
СН3-СН2-СН2-
Бутановая (масляная) кислота
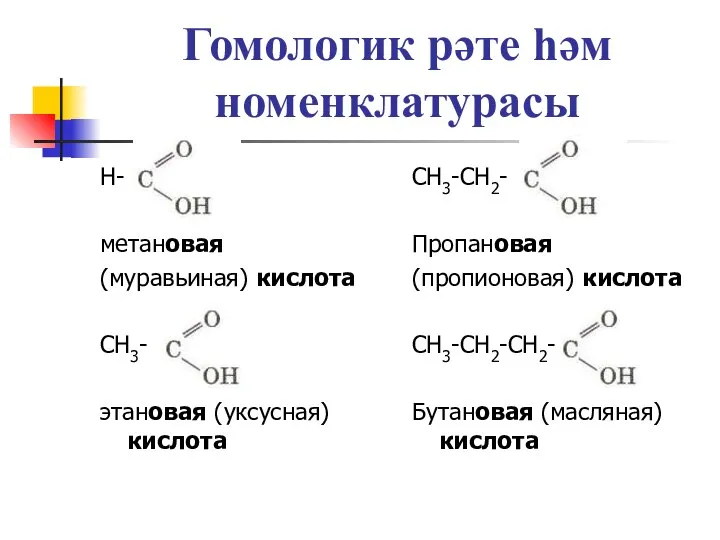
Слайд 6Матдәләрнең исемен атагыз
СН3-СН2-ОН
Слайд 7Формулага туры килүче исемен
Формуласы
1) СН3-СН2-ОН
2) С3Н8
3) СН3-ОН
4)
Исеме
а) пропан
б) метанол
в) этаналь
г) этанол
д)

этиловый спирт
е) метан
Слайд 8Иң көчле кислота
НСООН
CH3 - COOH
CH3 - CH2 - COOH
CH3 - CH2 -
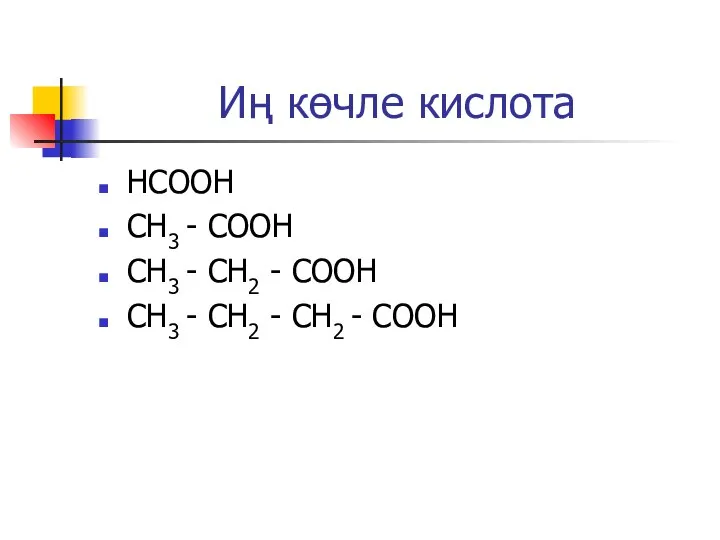
CH2 - COOH
Слайд 9Уксусная кислота в растворе реагирует с каждым веществом набора:
а) SiO2; KHSO4; (CuOH)2SO4;
б)

Na2 SO4; Mg(OH)2; Al;
в) NH3 ; FeO; NaHS
г)ZnO; CO; Fe:
Слайд 15
Карбон кислоталарының
химик үзлекләре

Слайд 16RCO - O -\- H арасындагы бәйләнеш өзелү белән бара

Слайд 17RCO – O-\- H арасындагы бәйләнеш өзелү белән бара
1) Ионнарга таркала

Слайд 18RCO - O -\- H арасындагы бәйләнеш өзелү белән бара
2) Металлар белән

реагирлаша
Mg + 2CH3COOH→(CH3COO)2Mg + H2
3) Металл оксидлары белән реагирлаша
CaO+2CH3COOH → (CH3COO)2Ca+H2O
Слайд 19RCO - O -\- H арасындагы
бәйләнеш өзелү белән бара
4) Нигезләр

белән реагирлаша
а) селтеләр
CH3COOH+NaOH→CH3COONa+H2O
б) суда эремәүче нигезләр
2CH3COOH+Cu(OH)2 →(CH3COO)2Cu+2H2O
Слайд 20RCO - O -\-H арасындагы бәйләнеш өзелү белән бара
5) Тозлар белән реагирлаша
2CH3COOH+CaCO3→(CH3COO)2Ca+CO2+H2O

Слайд 21Яңа тема
С -\– ОН арасындагы бәйләнеш
өзелү белән бара

Слайд 22С -\– ОН арасындагы бәйләнеш
өзелү белән бара
Спиртлар белән реагирлаша
Кислота һәм
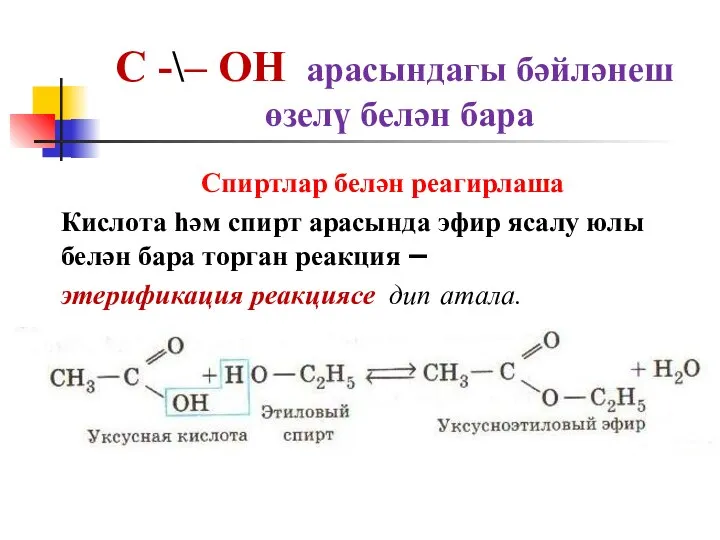
спирт арасында эфир ясалу юлы белән бара торган реакция –
этерификация реакциясе дип атала.
Слайд 23С -\– ОН арасындагы бәйләнеш
өзелү белән бара
CH3- +PCl5→CH3-COCl + POCl3+HCl
хлорангидрид
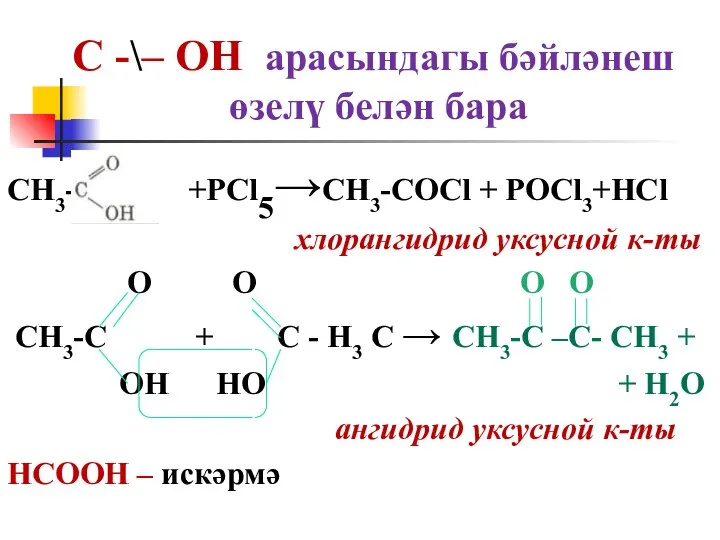
уксусной к-ты
О О О О
CH3-С + С - H3 С → CH3-С –С- CH3 +
ОН НО + H2O
ангидрид уксусной к-ты
НСООН – искәрмә
Слайд 24ангидридлар
Гидролизлаша
CH3-СО –СО- CH3 + H2O →2 CH3-
Аммиак белән реакциягә керә
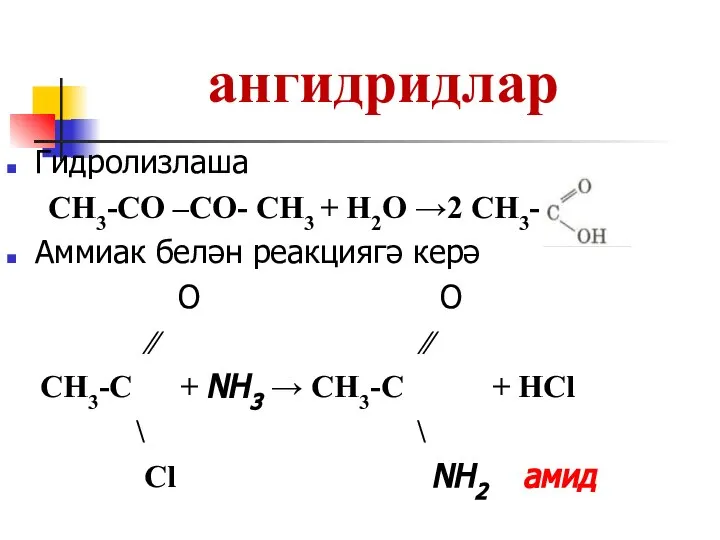
О O
∕∕ ∕∕
CH3-С + NH3 → CH3-C + НCl
\ \
Cl NH2 амид
Слайд 25Амидлар
О
∕∕
CH3-C --t→ CH3-C≡N + H2O
\ нитрил
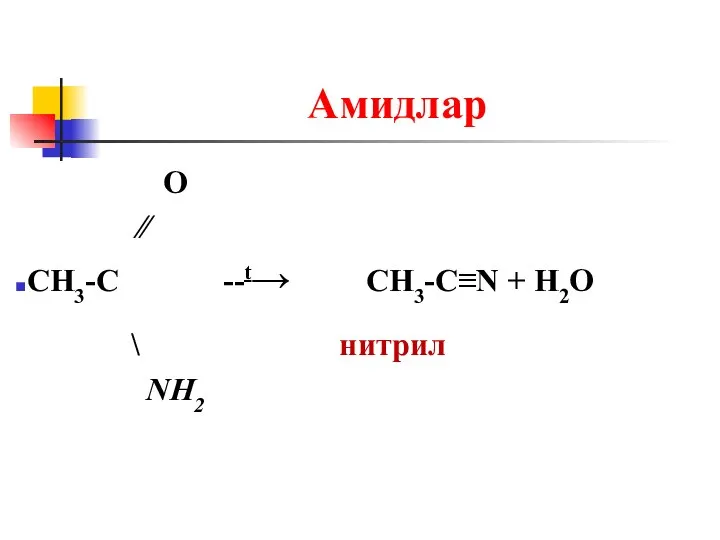
NH2
Слайд 26Углеводород радикалы катнашында бара торган реакцияләр

Слайд 27Углеводород радикалы катнашында бара торган реакцияләр
Pкрасн t
CH3-COOH + Cl2 CH2 COOH
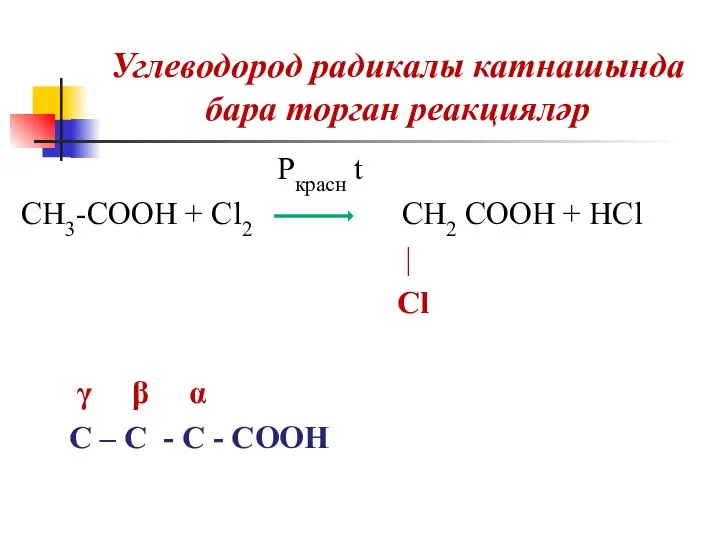
+ HCl
|
Cl
γ β α
C – C - C - COOH
Слайд 28C ≠̸=O арасындагы бәйләнеш
өзелү белән бара
Гидрирование ( восстановление)
CH3 – COOH +
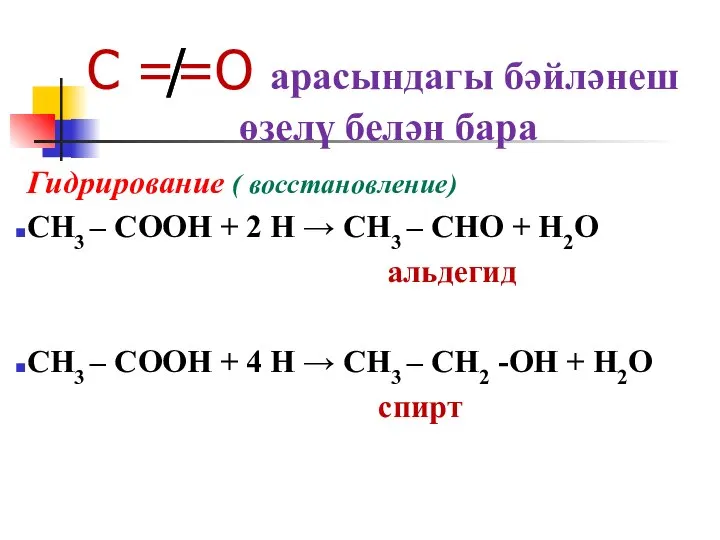
2 H → CH3 – CHO + H2O
альдегид
CH3 – COOH + 4 H → CH3 – CH2 -OH + H2O
спирт
Слайд 29Карбон кислоталары тулысынча оксидлаша
CH3 – COOH + 2О2 → 2CO2 + 2H2O

Сn Н2n + 1СООН + 3n+1 О2 → (n+1)CO2 +
2 + (n+1)H2O
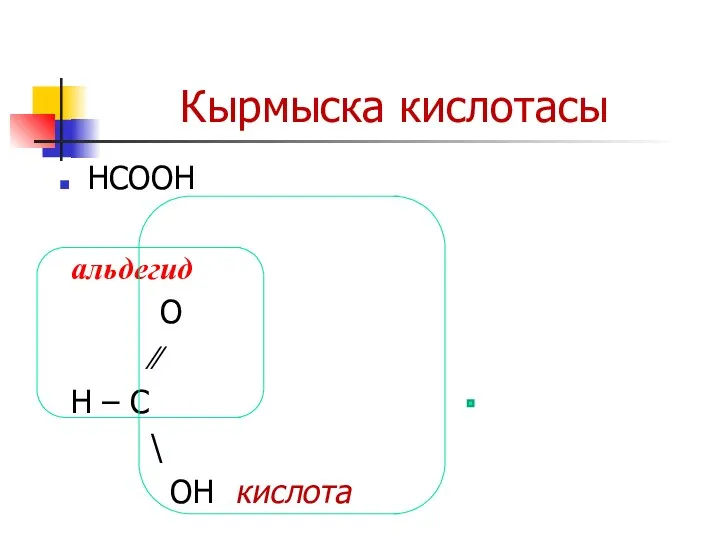
Слайд 30Кырмыска кислотасы
НСООН
альдегид
О
∕∕
Н – С
\
OH кислота
Слайд 31Кырмыска кислотасы
H2 SO4 (k), t
НСООН CO + H2O
t
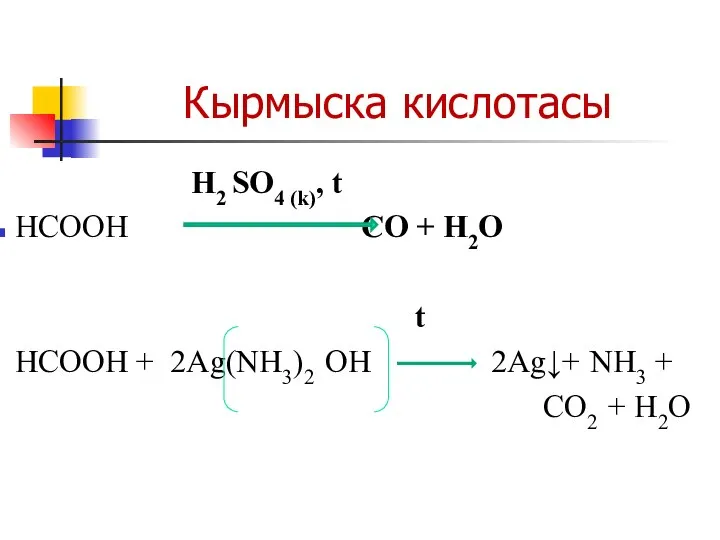
НСООН + 2Ag(NH3)2 OH 2Ag↓+ NH3 +
CO2 + H2O
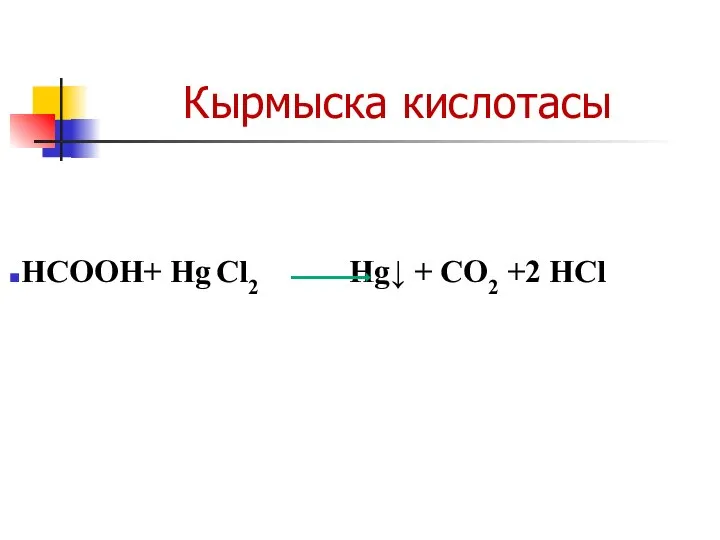
Слайд 32Кырмыска кислотасы
НСООН+ Hg Cl2 Hg↓ + CO2 +2 HCl
Слайд 34Иң көчле кислота
НСООН
CH2 Cl - COOH
CH2 F - COOH
CH3 - CH2 -
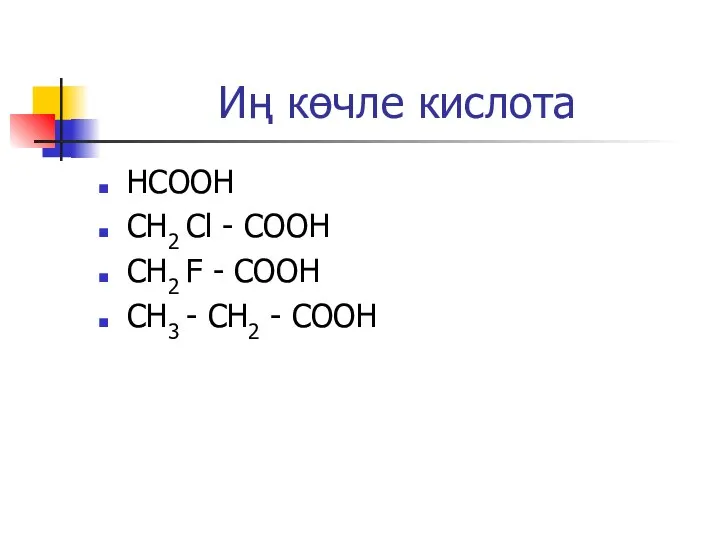
COOH
Слайд 35Ни одна карбоновая кислота не реагирует с
а) С2 Н5OH
б) PCl5
в) С6 Н5CH3
г)
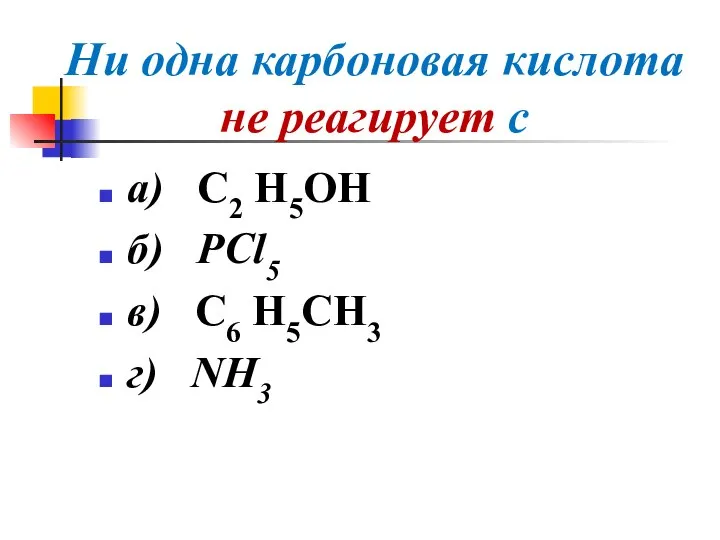
NH3
Слайд 36Молекуляр формуласын табарга
На нейтрализацию 18,5 г предельной одноосновной кислоты потребовался раствор, содержащий

10 г гидроксида натрия. Определите молекулярную формулу кислоты.
Слайд 37Молекуляр формуласын табарга
При взаимодействии 30 г предельного одноатомного спирта с металлическим натрием

выделилось 5,6 л газа. Определите молекулярную формулу спирта
Слайд 38Способность солей подвергаться гидролизу увеличивается в ряду:
а) С2 Н5 ONa; CH3 COONa;

С6 Н5 ONa
б) СН3 ONa; С2 Н5 ONa; С6 Н5 ONa
в) С6 Н5 ONa; С2 Н5 ONa; CH3 COONa
г) CH3 COONa ; С6 Н5 ONa; С2 Н5 ONa
Слайд 40Рефлексия
Дәрестә мин күп нәрсә белдем
Бу миңа тормышта кирәк булачак
Уйланырга урын бар
Кызыксындырган сорауларыма

җавап таптым
Дәрестә тырышып эшләдем






































 Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение) Установочная лекция по специальной химии для студентов специальности Прикладная геология
Установочная лекция по специальной химии для студентов специальности Прикладная геология Химияның негізгі түсініктері мен зандары
Химияның негізгі түсініктері мен зандары Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Патриотическое воспитание школьников на уроках
Патриотическое воспитание школьников на уроках Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения
Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения Синтез.Малахит
Синтез.Малахит О́лово — элемент 14-й группы периодической системы химических элементов
О́лово — элемент 14-й группы периодической системы химических элементов Химические формулы
Химические формулы Органические вещества клетки. Липиды. (10 класс)
Органические вещества клетки. Липиды. (10 класс) Основные законы химии
Основные законы химии Лабораторное оборудование. Тесты
Лабораторное оборудование. Тесты Алкены-1 (строение, изомерия, номенклатура)
Алкены-1 (строение, изомерия, номенклатура) Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Вода… Химические названия
Вода… Химические названия Свойства воды. Физические свойства
Свойства воды. Физические свойства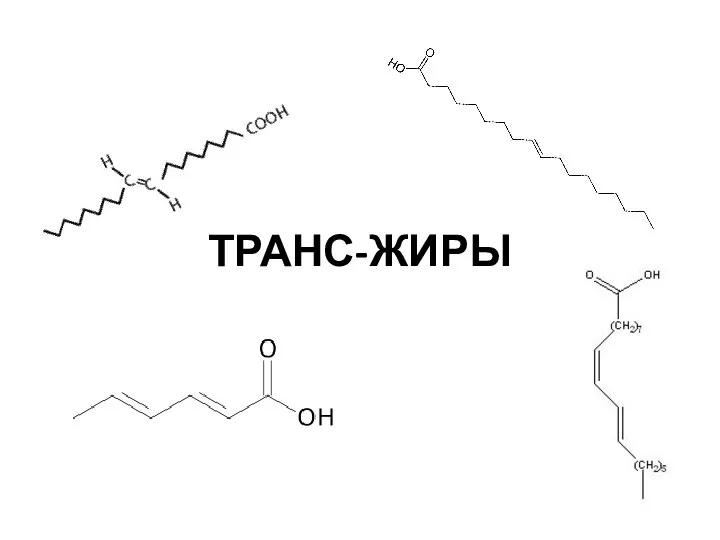 Транс-жиры
Транс-жиры Изомерия и ее виды
Изомерия и ее виды Химия ионных жидкостей
Химия ионных жидкостей Строение углеводородов
Строение углеводородов Основные понятия химии
Основные понятия химии Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого
Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Вольфрам
Вольфрам Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету
Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4)
Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4) Мышьяк (As)
Мышьяк (As)