Содержание
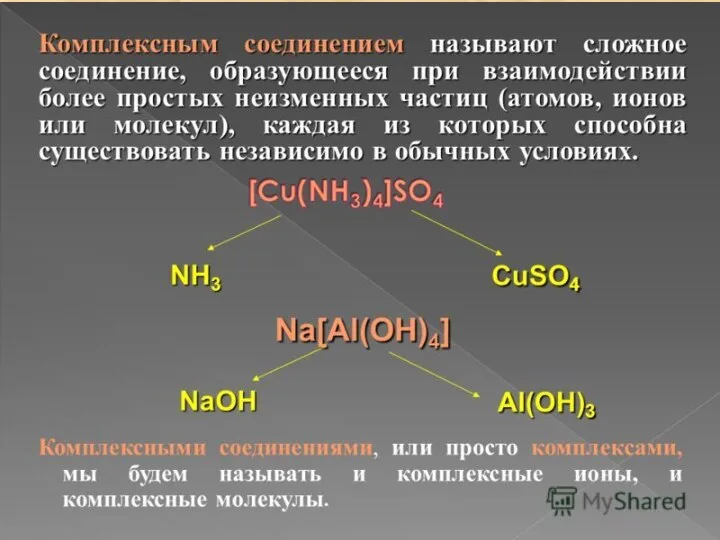
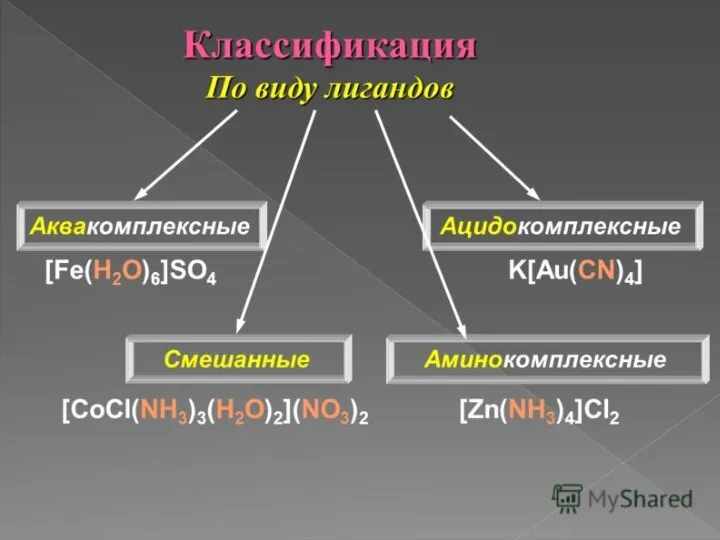
- 5. Комплексные называют соединения, содержащие сложные ионы и молекулы, способные к существованию как а кристаллическом виде, так
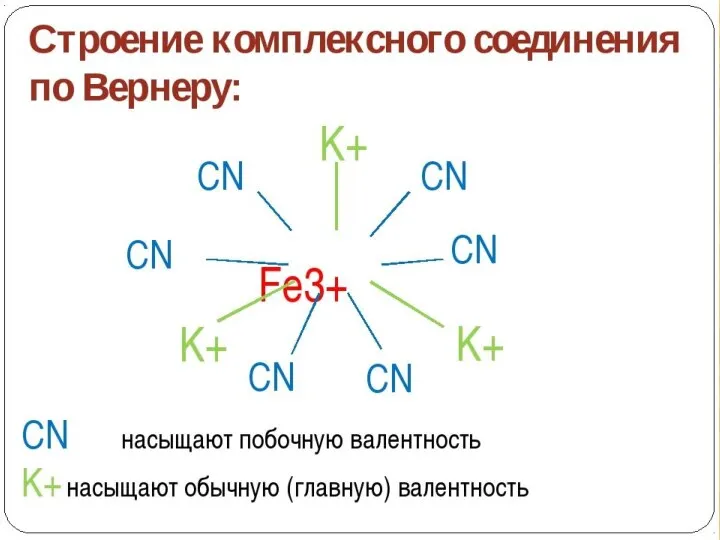
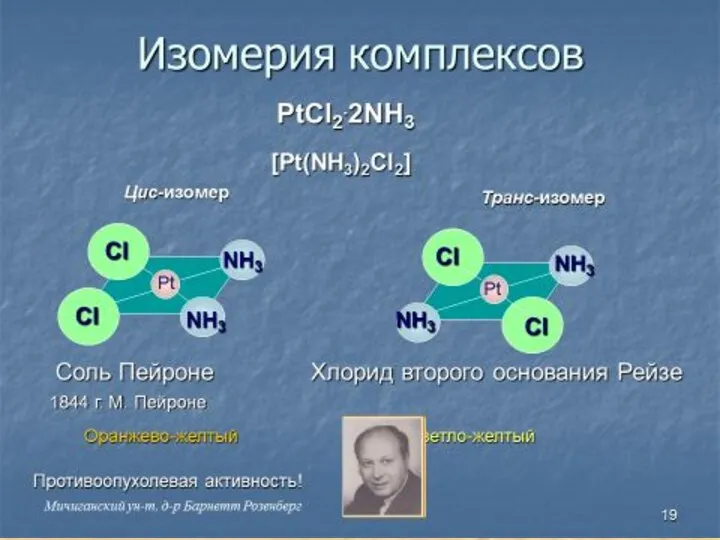
- 6. Главная и побочная валентности PtCl4.2NH3 Pt Cl Cl Cl Cl NH3 NH3 Главная валентность соответствует обычной
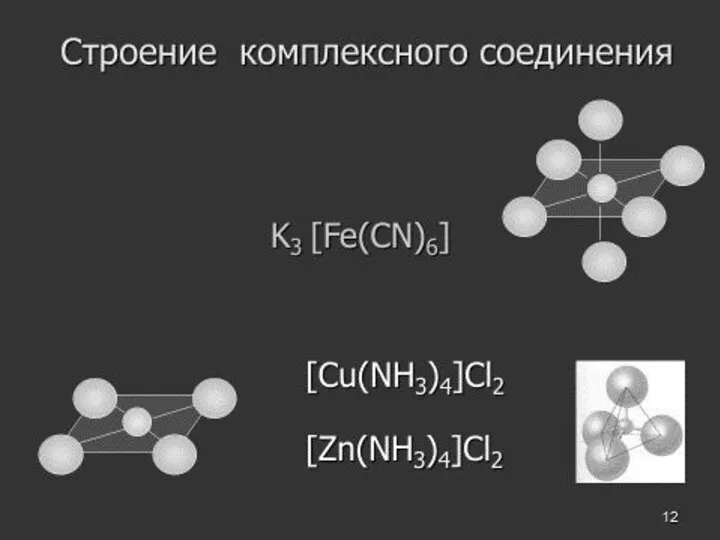
- 8. Состав. Согласно теории Вернера центральное положение в комплексных соединениях занимает, как правило, ион металла, который называют
- 9. Комплексообразователь – частица (атом, ион или молекула), координирующая (располагающая) вокруг себя другие ионы или молекулы.
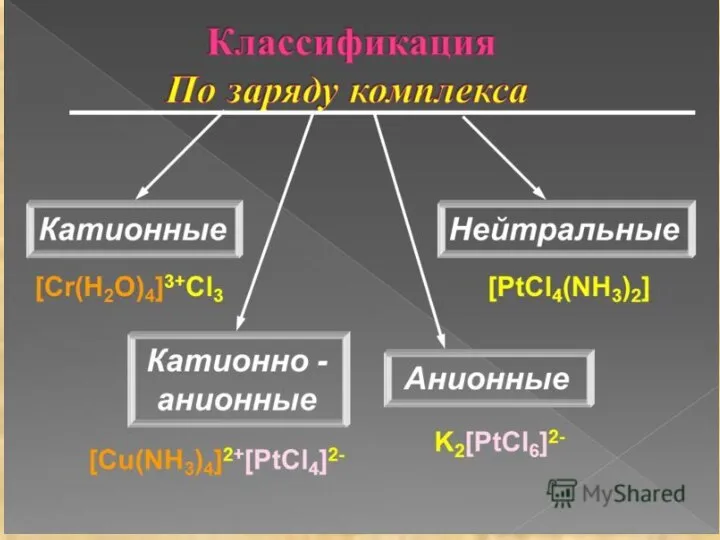
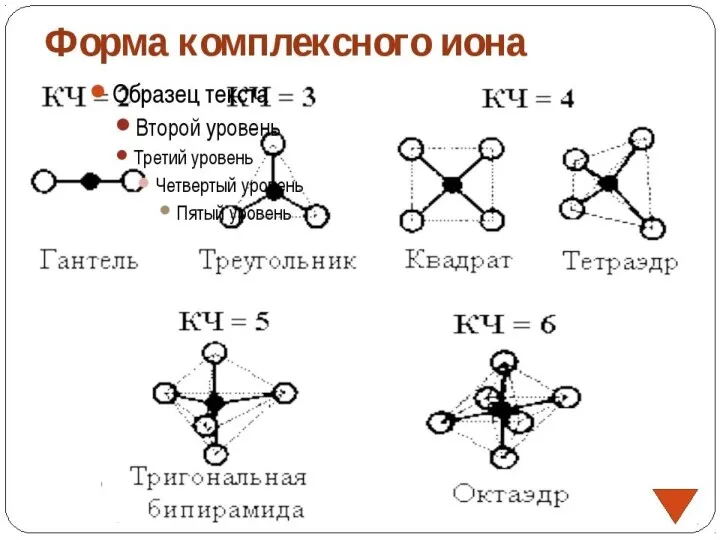
- 11. Комплексообразователь обычно имеет положительный заряд, является d-элементом, проявляет амфотерные свойства, имеет координационное число 4 или 6.
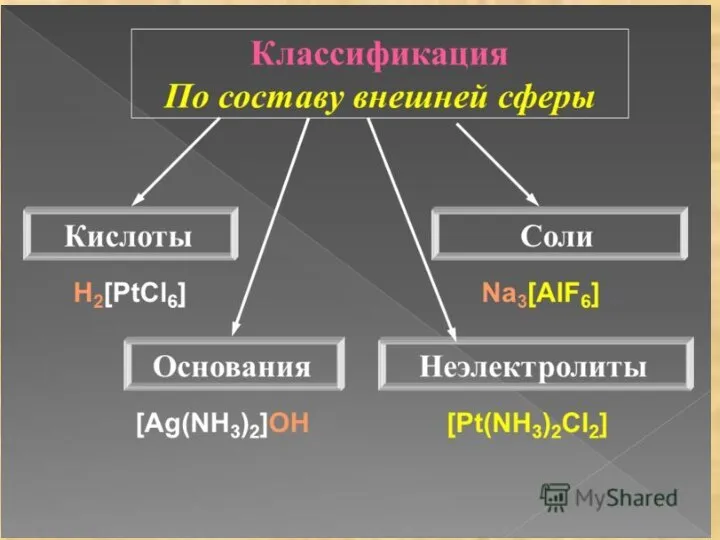
- 12. Лиганды – частицы (молекулы и ионы), координируемые комплексообразователем и имеющие с ним непосредственно химические связи (например,
- 13. [N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
- 14. Лиганды не связаны друг с другом, так как между ними действуют силы отталкивания. Когда лигандами являются
- 28. (OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x
- 29. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6]
- 48. Закрепление Заполните пропуски в листе рассказа «Комплексные соединения». Строение комплексных соединений объясняется с позиций … теории
- 50. Скачать презентацию









![[N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1030983/slide-12.jpg)











![(OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1030983/slide-27.jpg)
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1030983/slide-28.jpg)









 Строение вещества
Строение вещества Расстворение. Расстворы
Расстворение. Расстворы Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям 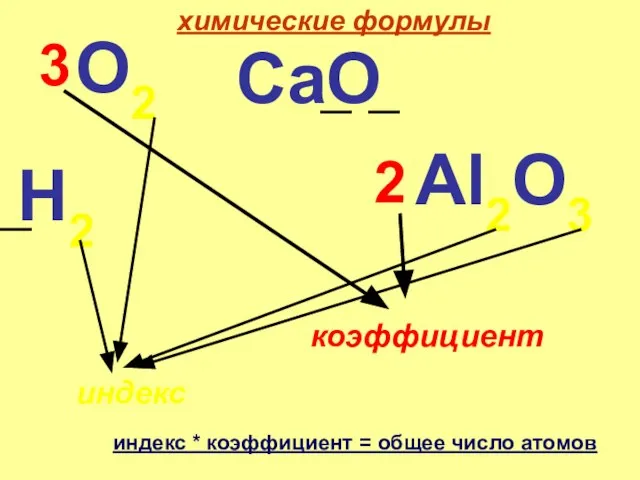 Химические формулы CaO
Химические формулы CaO Амины. Аминокислоты. Белки
Амины. Аминокислоты. Белки Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12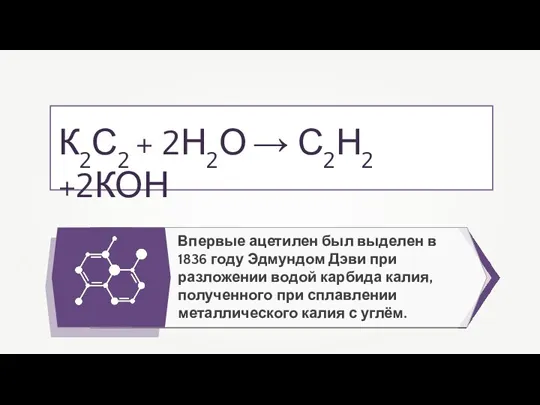 Физические и химические свойства алкинов
Физические и химические свойства алкинов Комісія хімічних дисциплін
Комісія хімічних дисциплін Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Презентация на тему Химия и проблемы экологии. Кислотные дожди
Презентация на тему Химия и проблемы экологии. Кислотные дожди  Строение и свойства предельных и непредельных углеводородов. . Обобщающий урок по химии 10 класс
Строение и свойства предельных и непредельных углеводородов. . Обобщающий урок по химии 10 класс Предмет органической химии
Предмет органической химии Квантовая химия
Квантовая химия Сходство химического состава клеток разных организмов как доказательство их родства
Сходство химического состава клеток разных организмов как доказательство их родства Поляризуемость. Эллипсоид поляризуемости и симметрия молекулы
Поляризуемость. Эллипсоид поляризуемости и симметрия молекулы Масляная кислота
Масляная кислота Ұнтақтар - дәрілік түр ретінде
Ұнтақтар - дәрілік түр ретінде тэд — без анимации(1)
тэд — без анимации(1) Этанол. Химические свойства этанола
Этанол. Химические свойства этанола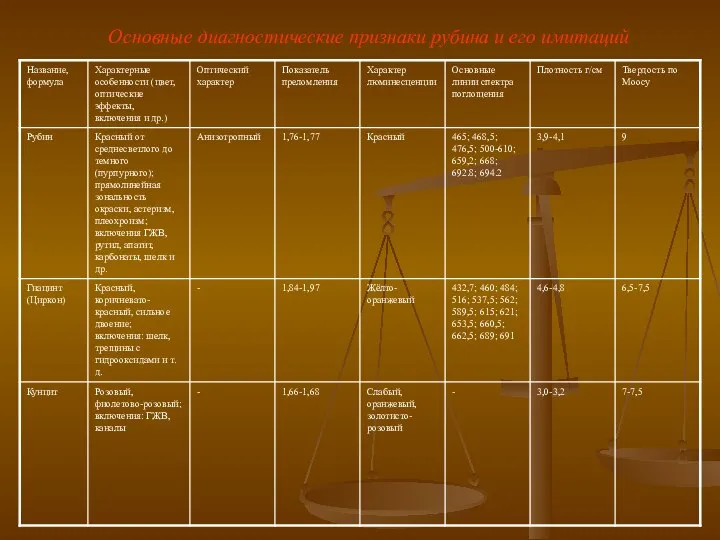 Основные диагностические признаки рубина и его имитаций
Основные диагностические признаки рубина и его имитаций Технология получения полиуретанов
Технология получения полиуретанов Удивительное рядом
Удивительное рядом Турнир знатоков. Интеллектуальная игра
Турнир знатоков. Интеллектуальная игра Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Пероксид водорода
Пероксид водорода