Содержание
- 2. Многоядерные Арены Приматические углеводороды, содержащие два и более бензольных ядер, относятся к многоядерным аренам. В зависимости
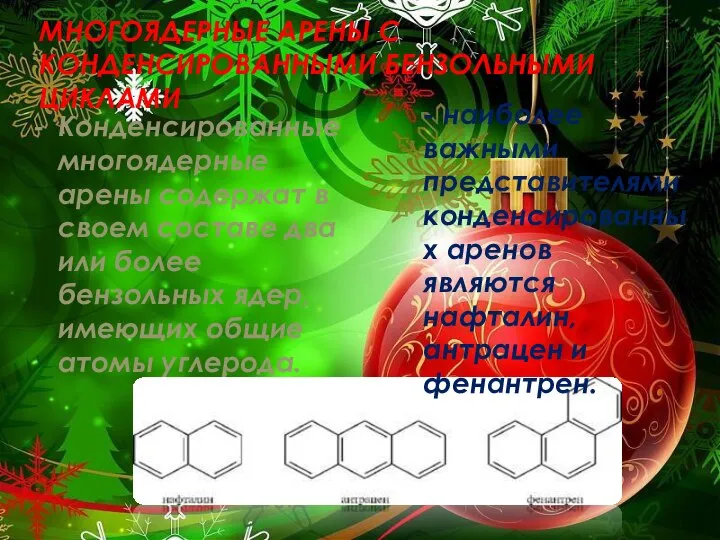
- 3. МНОГОЯДЕРНЫЕ АРЕНЫ С КОНДЕНСИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЦИКЛАМИ Конденсированные многоядерные арены содержат в своем составе два или более
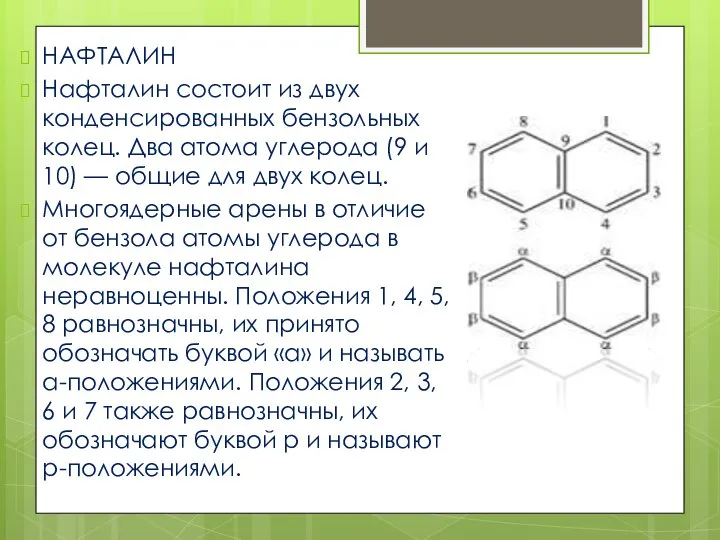
- 4. НАФТАЛИН Нафталин состоит из двух конденсированных бензольных колец. Два атома углерода (9 и 10) — общие
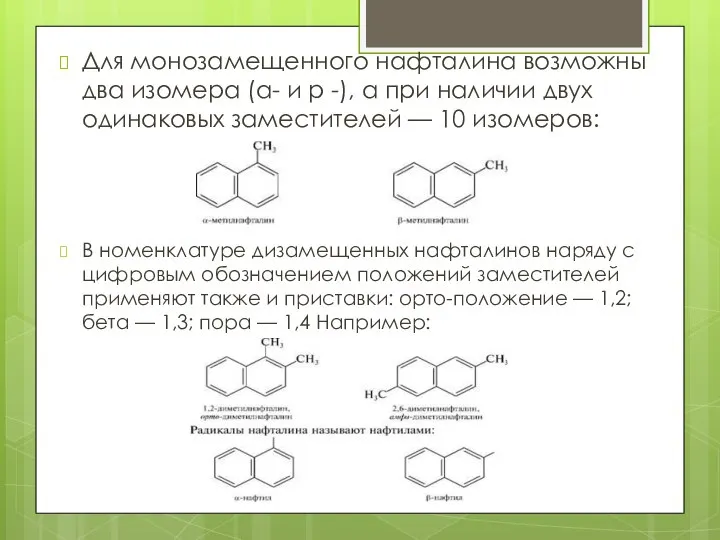
- 5. Для монозамещенного нафталина возможны два изомера (а- и р -), а при наличии двух одинаковых заместителей
- 6. Получение Нафталина. 1. В промышленности нафталин главным образом получают из каменноугольной смолы, где его содержание составляет
- 7. нафталин — кристаллическое вещество с характерным запахом, сублимируется при 81 °С. Не растворяется в воде, растворяется
- 8. Химические свойства Нафталина. Нафталин, как и бензол, проявляет свойства ароматических соединений; для него характерны прежде всего
- 9. Как видно, при атаке а-положения делокализация положительного заряда в с -комплексе происходит с сохранением ароматичности одного
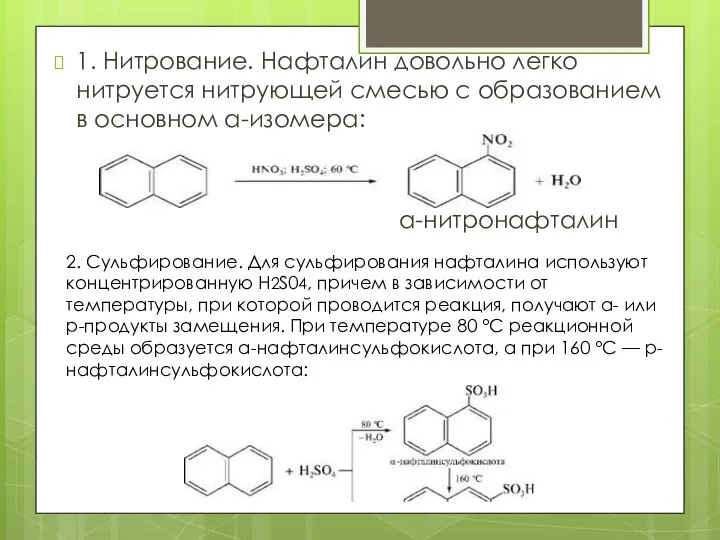
- 10. 1. Нитрование. Нафталин довольно легко нитруется нитрующей смесью с образованием в основном а-изомера: а-нитронафталин 2. Сульфирование.
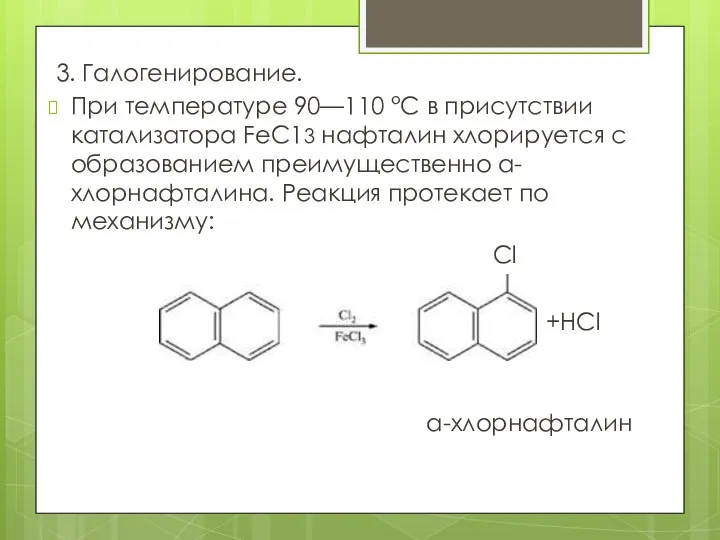
- 11. 3. Галогенирование. При температуре 90—110 °С в присутствии катализатора FеС13 нафталин хлорируется с образованием преимущественно а-хлорнафталина.
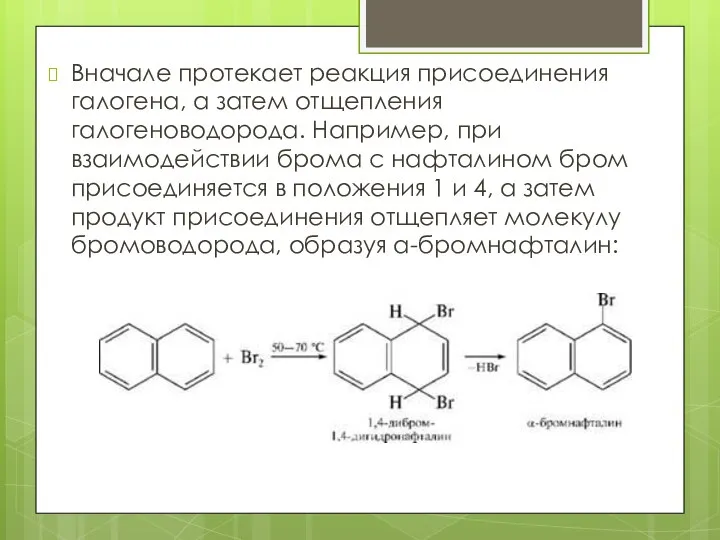
- 12. Вначале протекает реакция присоединения галогена, а затем отщепления галогеноводорода. Например, при взаимодействии брома с нафталином бром
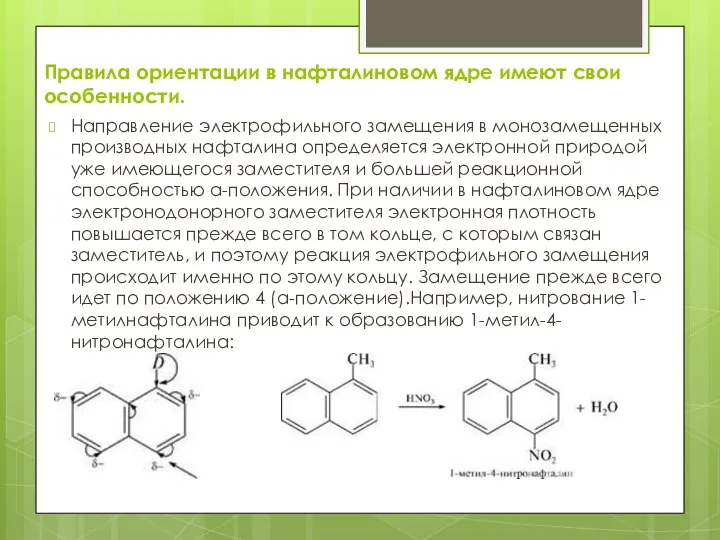
- 13. Правила ориентации в нафталиновом ядре имеют свои особенности. Направление электрофильного замещения в монозамещенных производных нафталина определяется
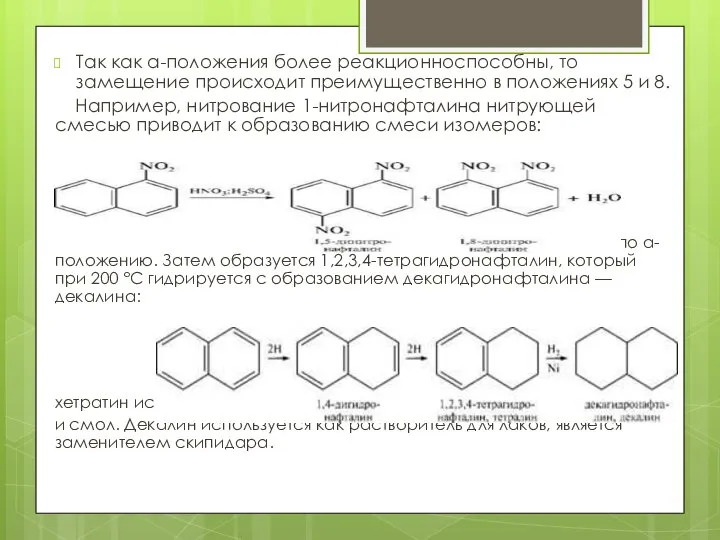
- 14. Так как а-положения более реакционноспособны, то замещение происходит преимущественно в положениях 5 и 8. Например, нитрование
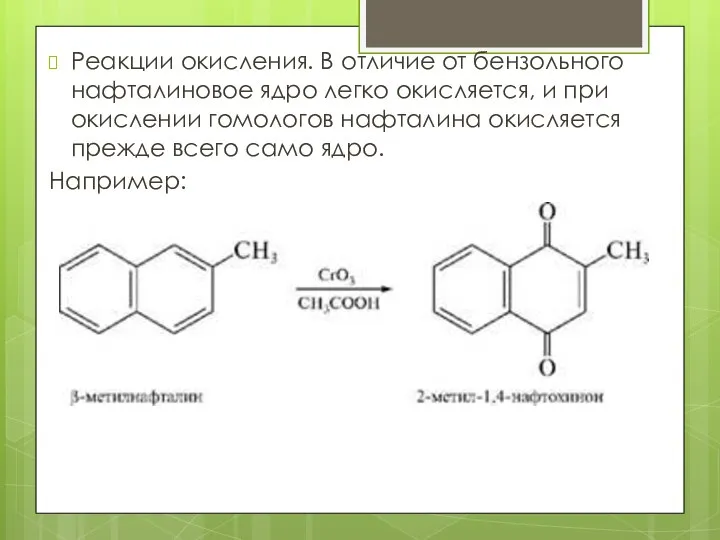
- 15. Реакции окисления. В отличие от бензольного нафталиновое ядро легко окисляется, и при окислении гомологов нафталина окисляется
- 16. Антрацен это многоядерное соединение, состоящее из трех линейно конденсированных бензольных колец. В молекуле антрацена нумеруются лишь
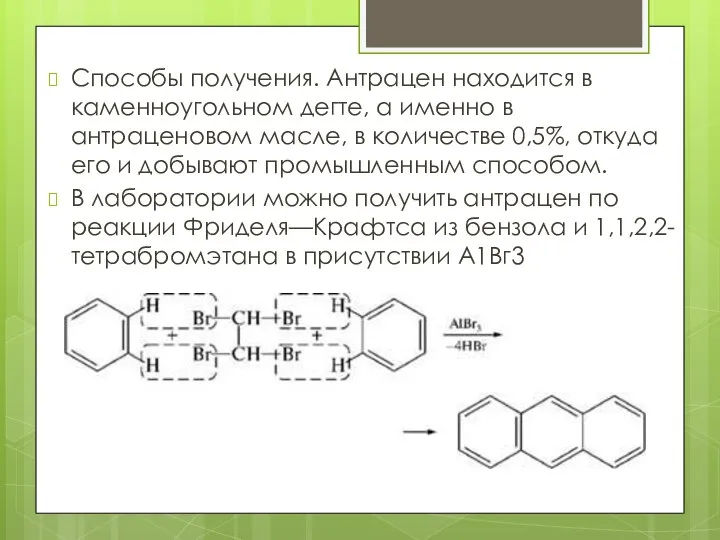
- 17. Способы получения. Антрацен находится в каменноугольном дегте, а именно в антраценовом масле, в количестве 0,5%, откуда
- 18. Физические свойства. Антрацен — это бесцветное кристаллическое вещество, температура плавления 217 °С, перегоняющееся с водяным паром,
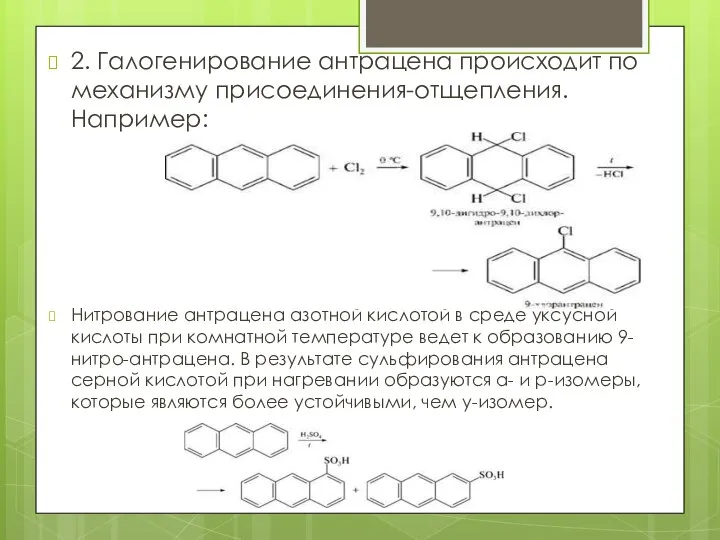
- 19. 2. Галогенирование антрацена происходит по механизму присоединения-отщепления. Например: Нитрование антрацена азотной кислотой в среде уксусной кислоты
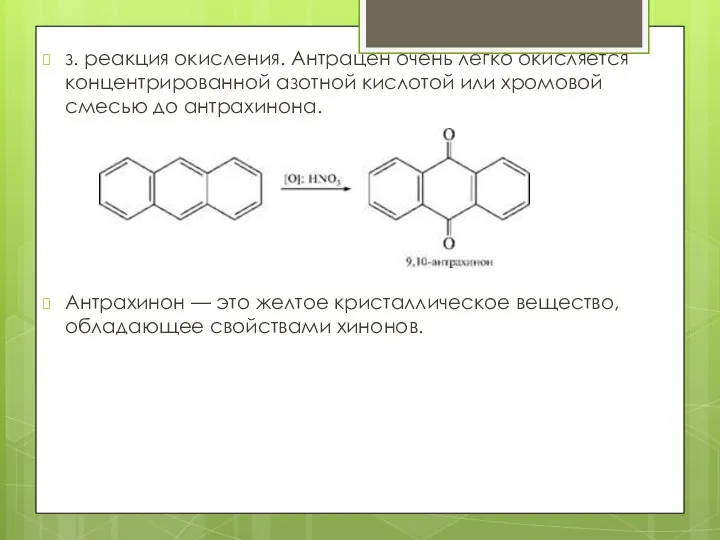
- 20. з. реакция окисления. Антрацен очень легко окисляется концентрированной азотной кислотой или хромовой смесью до антрахинона. Антрахинон
- 21. ФЕНАНТРЕН Структурным изомером антрацена является фенантрен. В антрацене три бензольных кольца соединены линейно, тогда как в
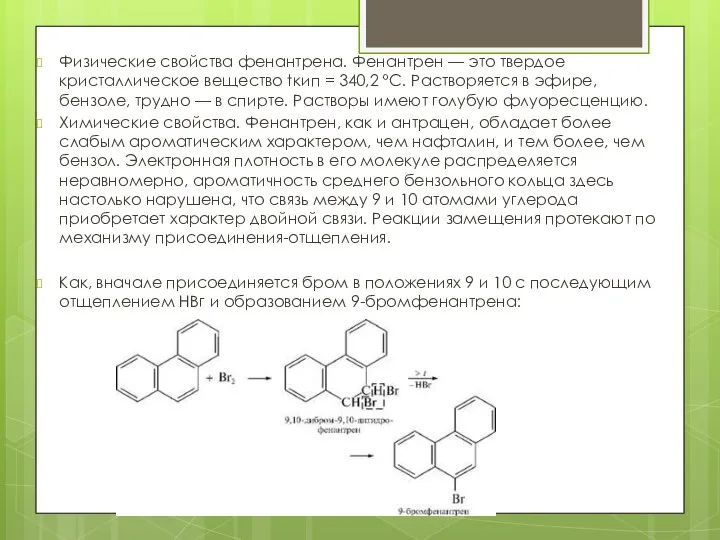
- 22. Физические свойства фенантрена. Фенантрен — это твердое кристаллическое вещество tкип = 340,2 °С. Растворяется в эфире,
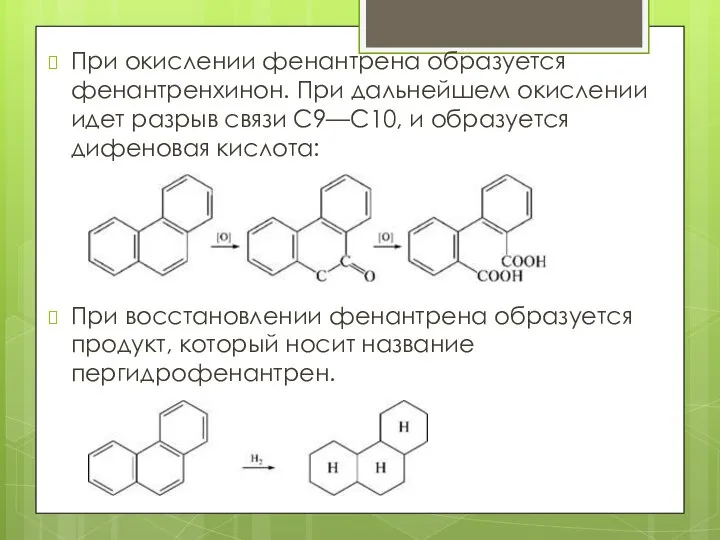
- 23. При окислении фенантрена образуется фенантренхинон. При дальнейшем окислении идет разрыв связи С9—С10, и образуется дифеновая кислота:
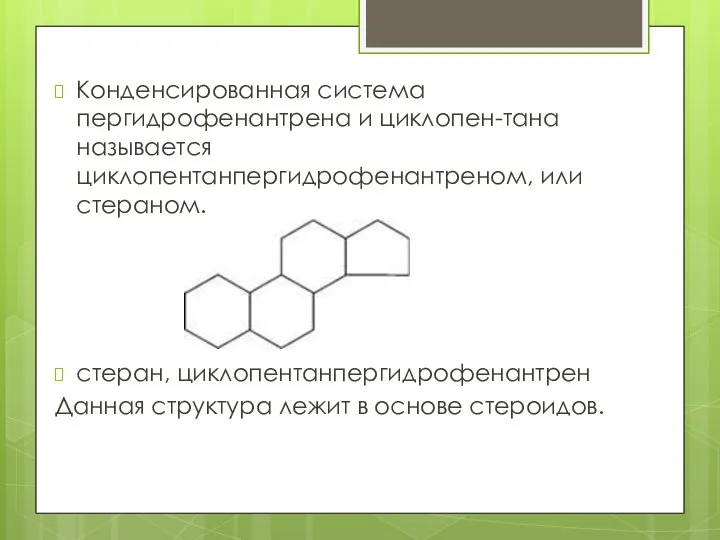
- 24. Конденсированная система пергидрофенантрена и циклопен-тана называется циклопентанпергидрофенантреном, или стераном. стеран, циклопентанпергидрофенантрен Данная структура лежит в основе
- 26. Скачать презентацию








 Презентация на тему СПИРТЫ (аканолы, алкоголи)
Презентация на тему СПИРТЫ (аканолы, алкоголи)  Химические реакции
Химические реакции Химия нефти и газа
Химия нефти и газа Простые вещества - металлы
Простые вещества - металлы Типы химических реакций
Типы химических реакций Пищевые добавки
Пищевые добавки Геохимический барьер
Геохимический барьер Химия ионных жидкостей
Химия ионных жидкостей Подготовка к ЕГЭ
Подготовка к ЕГЭ Строение вещества
Строение вещества Теория активированного комплекса
Теория активированного комплекса Презентация на тему Неогранические соединения. Периодическая таблица
Презентация на тему Неогранические соединения. Периодическая таблица  Строение вещества
Строение вещества Растворы
Растворы Неон
Неон Жаңа синтетикалық есірткілер
Жаңа синтетикалық есірткілер Презентация на тему Оксид кремния
Презентация на тему Оксид кремния  9 кл Урок 14 Ступінь дисоціації
9 кл Урок 14 Ступінь дисоціації Ионные уравнения реакций
Ионные уравнения реакций Химические формулы
Химические формулы Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия
Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия Комплексное задание по дисциплине основы материаловедения для группы 18
Комплексное задание по дисциплине основы материаловедения для группы 18 Из опыта формирования и развития универсальных учебных действий при изучении темы Неметаллы
Из опыта формирования и развития универсальных учебных действий при изучении темы Неметаллы Контрольная работа
Контрольная работа Изомерия. Виды изомерии
Изомерия. Виды изомерии Презентация на тему Химические синонимы
Презентация на тему Химические синонимы  Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Spectroscopy. U.V. Lect.2
Spectroscopy. U.V. Lect.2