Слайд 2А1 Электронная формула внешнего энергетического уровня иона S2-:
А) 3s23p2
Б) 3s23p4
В) 3s23p6
Г) 4s24p6
А2.В ряду химических

элементов Te – Se – S – O способность неметаллов присоединять электроны:
А) Уменьшается
В) Не изменяется
Б) Увеличивается
Г) Изменяется периодически
Слайд 3А3.Оксиды с общей формулой ЭО2 и летучие водородные соединения с общей формулой ЭН4 образуют

элементы подгруппы:
А) углерода
Б )азота
В) кислорода
Г) фтора
А4. Сера проявляет степень окисления +4 в соединении:
А) H2S б) К2SO4 В) K2SO3 Г) SO3.
Слайд 4А5. Коэффициент перед формулой окислителя в уравнении реакции, схема которой
NH3 + O2 → N2 +

H2O, равен
А) 6
Б) 2
В) 4
Г) 3
А6. Оксид углерода (II) проявляет восстановительные свойства при нагревании c:
А) Fe2O3; Б) N2; В) Fe; Г) CO2.
Слайд 5А7. Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между

азотной кислотой и карбонатом кальция соответственно равны:
А) 10 и 3
Б)17 и 5
В)12 и 4
Г)10 и 6
Слайд 6Часть С
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
SO3 → H2SO4 → K2SO4 → BaSO4
.






 Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Презентация на тему Анализ качества питьевой воды
Презентация на тему Анализ качества питьевой воды 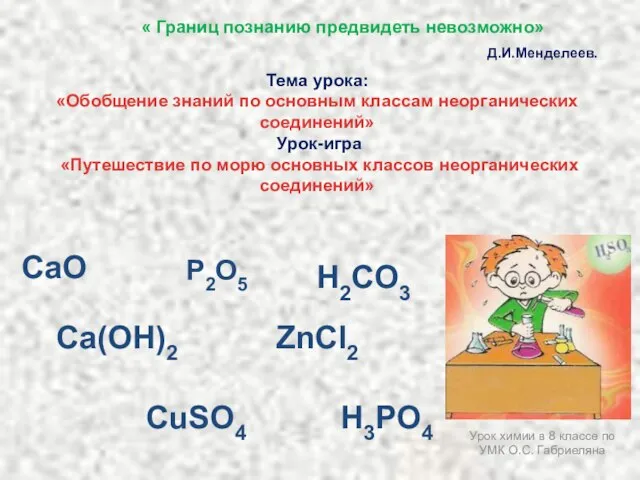 Путешествие по морю
Путешествие по морю Химическая технология. Структура ВКР
Химическая технология. Структура ВКР Галогены. Возможные степени окисления
Галогены. Возможные степени окисления Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Механизмы двухсубстатных реакций
Механизмы двухсубстатных реакций Путешествие по городу химиков
Путешествие по городу химиков Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)  Ионные уравнения
Ионные уравнения Типы химических реакций. 8 класс
Типы химических реакций. 8 класс НХ 6 Растворы Коллигативные свойства
НХ 6 Растворы Коллигативные свойства Щелочные металлы
Щелочные металлы План для домашней работы по теме Алкадиены
План для домашней работы по теме Алкадиены 4505ab8713f54e72bb388461c5e134ac (1)
4505ab8713f54e72bb388461c5e134ac (1) Промышленный биокатализ
Промышленный биокатализ Структура периодической таблицы элементов
Структура периодической таблицы элементов Вспомогательные средства для стирки
Вспомогательные средства для стирки Опасные химические вещества
Опасные химические вещества Стекло
Стекло Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Техника титрования и лабораторная посуда
Техника титрования и лабораторная посуда Полимеры и пластмассы
Полимеры и пластмассы Перегонка. Вклад алхимиков в органическую химию
Перегонка. Вклад алхимиков в органическую химию Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Презентация на тему Алюминий(Al)
Презентация на тему Алюминий(Al)  Химическая связь. Урок-упражнение
Химическая связь. Урок-упражнение