Содержание
- 2. Типы межмолекулярных взаимодействий Вандерваальсовы силы Водородная связь
- 3. И. Ван дер Ваальс голландский ученый, лауреат Нобелевской премии 1910 г.
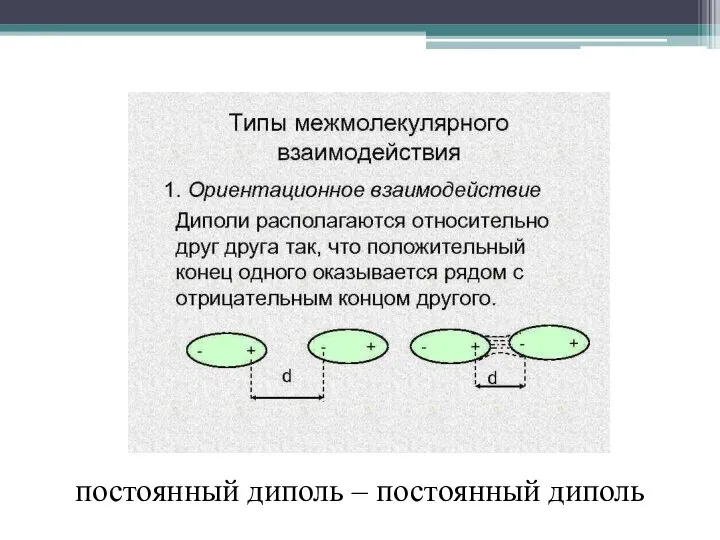
- 4. Ван-дер-ваальсова связь наиболее универсальный вид межмолекулярной связи, обусловлен ориентационным взаимодействием, (постоянный диполь – постоянный диполь) индукционным
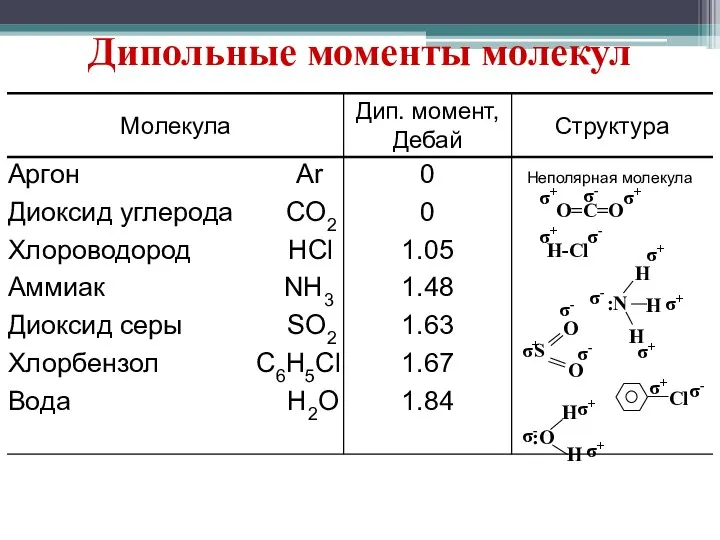
- 5. Диполь – дипольное притяжение осуществляется между молекулами с постоянными дипольными моментами. Дипольным моментом обладают только молекулы
- 6. Дипольные моменты молекул O=C=O H-Cl σ+ σ+ σ+ σ+ σ+ σ+ σ+ σ+ σ+ σ+ σ-
- 7. постоянный диполь – постоянный диполь
- 8. Индукционное притяжение осуществляется между полярными молекулами и некоторыми неполярными молекулами. Оно обусловлено возникновением у неполярной молекулы
- 9. постоянный диполь – индуцированный диполь
- 10. Дисперсионное притяжение возникает в результате мгновенных флуктуаций электронной плотности в молекулах. Электронные облака искажаются, что приводит
- 11. индуцированный диполь – мгновенный диполь
- 12. Водородная связь - сила притяжения, возникающая между атомом водорода и электроотрицательным атомом
- 13. Водородная связь Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому,
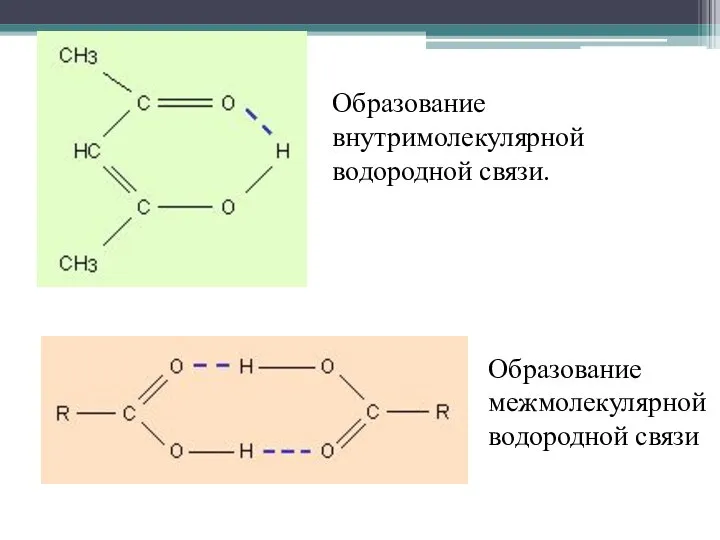
- 14. Образование внутримолекулярной водородной связи. Образование межмолекулярной водородной связи
- 15. Фтороводород образует нестойкие соединения с водой по донорно-акцепторному механизму При низких температурах фтористый водород образует нестойкие
- 16. Слабые и сильные водородные связи Слабые водородные связи (водородные связи в воде, аммиаке, метаноле) Сильные водородные
- 17. Влияние межмолекулярных сил на структуру и свойства Диполь-дипольное притяжение обуславливает втягивание молекул воды с поверхности внутрь
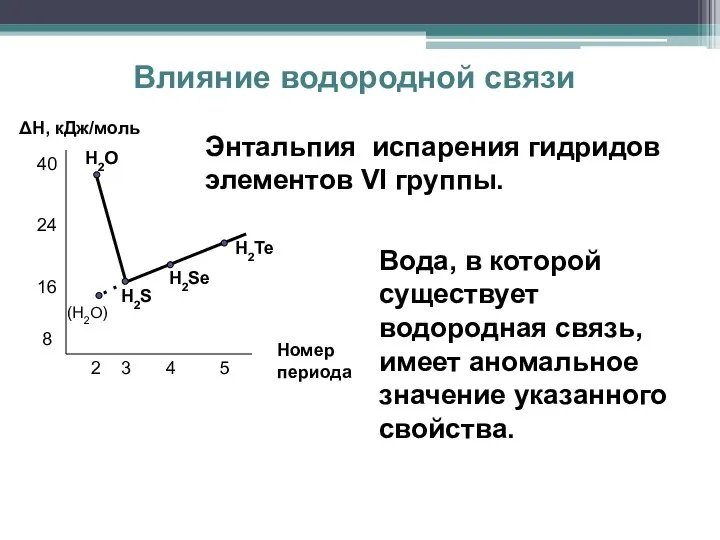
- 18. Влияние водородной связи H2O (H2O) H2S H2Se H2Te 2 3 4 5 Номер периода 40 24
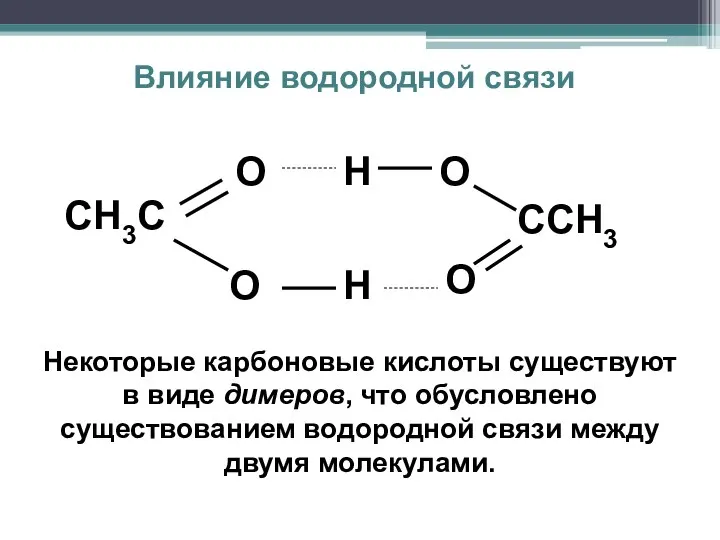
- 19. Влияние водородной связи ССН3 Н О СН3С О О О Н Некоторые карбоновые кислоты существуют в
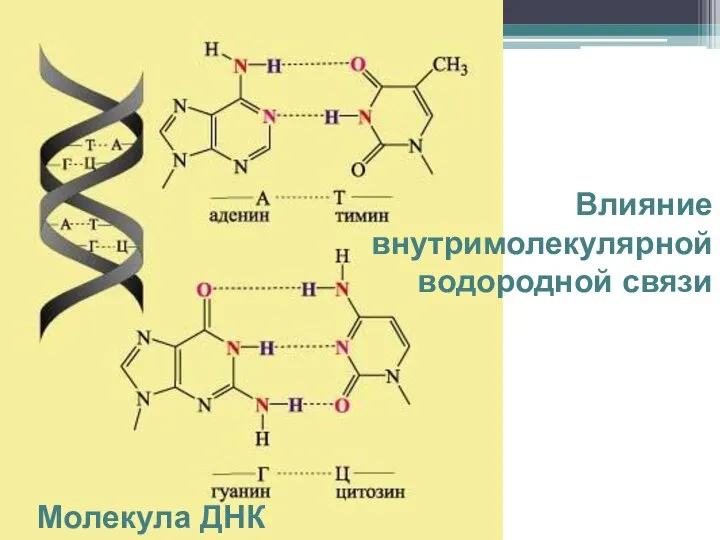
- 20. Влияние внутримолекулярной водородной связи Молекула ДНК
- 21. Влияние вандерваальсовых сил Молекулы с большим числом электронов и более диффузным распределением электронов притягиваются друг к
- 22. Т кип, °С Метан Бутан -164,0 -0,5 С С – С – С – С Н
- 23. Пропан-бутановая смесь Бутан -0,5 Пропан -43 Сжиженный бутан в чистом виде не будет работать при отрицательных
- 24. Т кип, °С Йод J2 Хлор Cl2 165 -35 106 электронов 34 электрона
- 25. Вандерваальсовы силы обуславливают также связывающее взаимодействие между соседними слоями в кристаллах со слоистой структурой, как в
- 26. Выводы по теме: 1. Межмолекулярные взаимодействия имеют как электростатическую, так и донорно-акцепторную природу и отличаются от
- 27. Вопросы к лекции 1. Какова природа преобладающих сил межмолекулярного взаимодействия в системе H2O2– НF: а) дисперсионное
- 29. Скачать презентацию




















 Химический анализ воды
Химический анализ воды Классификация ХГ методов разделения
Классификация ХГ методов разделения Лекция 3
Лекция 3 Презентация на тему Многообразие карбоновых кислот
Презентация на тему Многообразие карбоновых кислот  Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Продолжение классификации
Продолжение классификации Простые вещества – металлы и неметаллы
Простые вещества – металлы и неметаллы Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия Самородные металлы
Самородные металлы Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии Металлургия
Металлургия Презентация на тему Химические реакции
Презентация на тему Химические реакции  Углеводороды: изомерия
Углеводороды: изомерия Опыт Пилатра де Розьера
Опыт Пилатра де Розьера Вольфрам
Вольфрам Альдегиды, строение и свойства
Альдегиды, строение и свойства Кислород
Кислород Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Химический анализ
Химический анализ Сероводород. Соединения серы
Сероводород. Соединения серы Физическая химия растворов электролитов
Физическая химия растворов электролитов Алканы. Этан
Алканы. Этан Соль не только блюдо
Соль не только блюдо Аппаратурное оформление процесса гидроочистки нефтяных фракций
Аппаратурное оформление процесса гидроочистки нефтяных фракций MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Материаловедение для пирсера. Материалы, используемые в пирсинге
Материаловедение для пирсера. Материалы, используемые в пирсинге Создание из таблицы Менделеева и растворимости мини-справочник - шпаргалку
Создание из таблицы Менделеева и растворимости мини-справочник - шпаргалку Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2)