Содержание
- 2. Р-ции между ионами называют ионными реакциями, а уравнения таких р-ций – ионными уравнениями. Большинство хим. р-ий
- 3. . Реакции ионного обмена записывают тремя уравнениями: 1)Молекулярное 2) Полное ионно-молекулярное 3) сокращенное ионно-молекулярное
- 4. 1) Написать молекулярное уравнение реакции: Na2SO4 + BaCl2 → 2NaCl + BaSO4 2) С помощью таблицы
- 5. 5) Выписываем формулы и знаки тех ионов, которые остались и участвовали в реакции: SO42- + Ba2+
- 6. Реакции ионного обмена протекают до конца, если в результате реакции образуется вода (1), осадок(2) или газ(3).
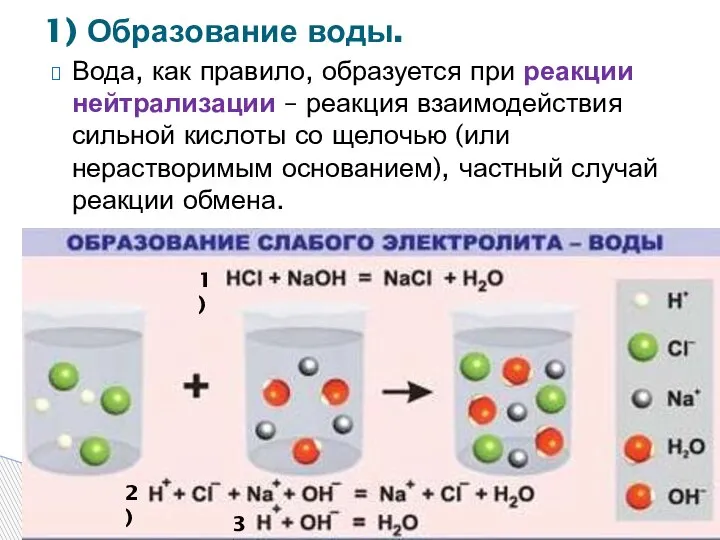
- 7. Вода, как правило, образуется при реакции нейтрализации – реакция взаимодействия сильной кислоты со щелочью (или нерастворимым
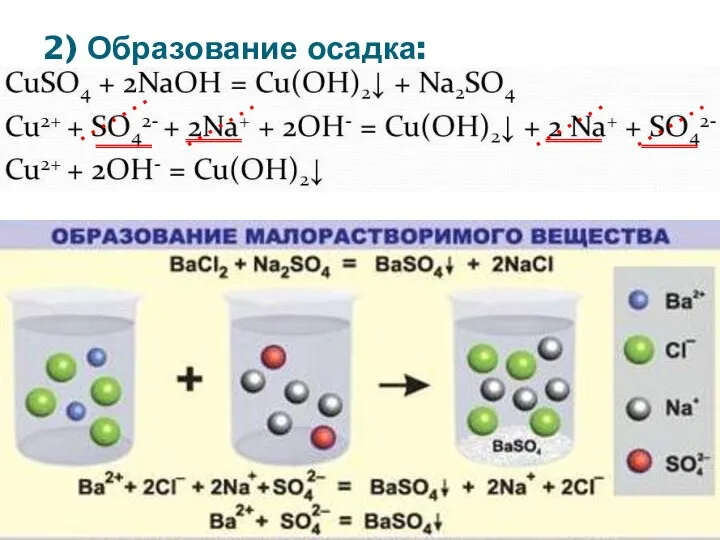
- 8. 2) Образование осадка:
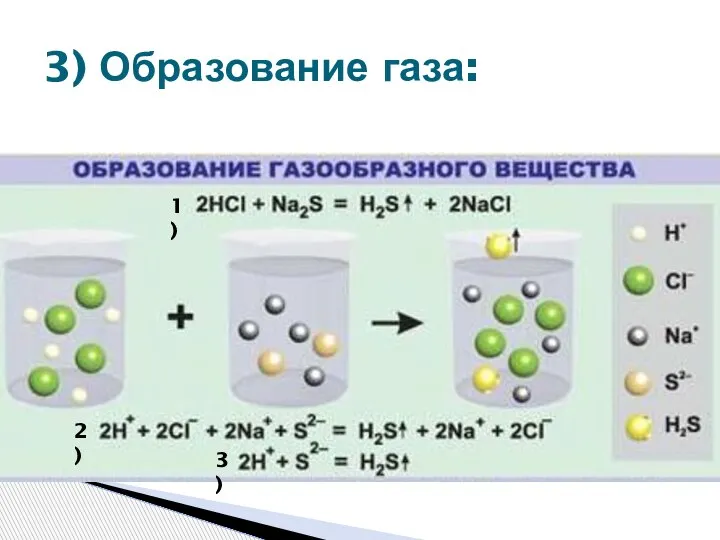
- 9. 3) Образование газа: 1) 2) 3)
- 11. Вариант № 1(1а,б,в, 2а) Вариант № 2 (1г,д,е, 2б)
- 13. Скачать презентацию







 Органические вещества
Органические вещества Модель Андерсона
Модель Андерсона Презентация на тему Сплавы металлов (9 класс)
Презентация на тему Сплавы металлов (9 класс)  Бордос сұйықтығын дайындау және оның сапасын тексеру
Бордос сұйықтығын дайындау және оның сапасын тексеру Презентация на тему Применение кислорода
Презентация на тему Применение кислорода  Теория валентных связей
Теория валентных связей Метаболизм липидов
Метаболизм липидов Методи визначення корозійної стійкості матеріалів (тема 11)
Методи визначення корозійної стійкості матеріалів (тема 11) Биохимия крови
Биохимия крови Известняк. Разновидности известняка. Области применения
Известняк. Разновидности известняка. Области применения Химическая связь в органических соединениях
Химическая связь в органических соединениях Спирты и фенолы
Спирты и фенолы Химические свойства и получение насыщенных одноатомных спиртов
Химические свойства и получение насыщенных одноатомных спиртов Khim_8
Khim_8 Предельные одноатомные спирты
Предельные одноатомные спирты Аминокислоты. Пептиды. Белки. Тема 2
Аминокислоты. Пептиды. Белки. Тема 2 Презентация на тему по химии витамины
Презентация на тему по химии витамины  Астат. Свойства астата
Астат. Свойства астата Якісні реакції органічних речовин
Якісні реакції органічних речовин Степень окисления
Степень окисления Кетоны
Кетоны Сложные реакции
Сложные реакции Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Сходство химического состава клеток разных организмов как доказательство их родства
Сходство химического состава клеток разных организмов как доказательство их родства Свойства веществ
Свойства веществ Конструирование макромолекул методом ATRP
Конструирование макромолекул методом ATRP Применение алканов
Применение алканов