Содержание
- 3. Жидкие растворы. Способы выражения состава растворов. Растворимость. Энергетика процессов растворения, влияние энтальпийного и энтропийного факторов. Идеальные
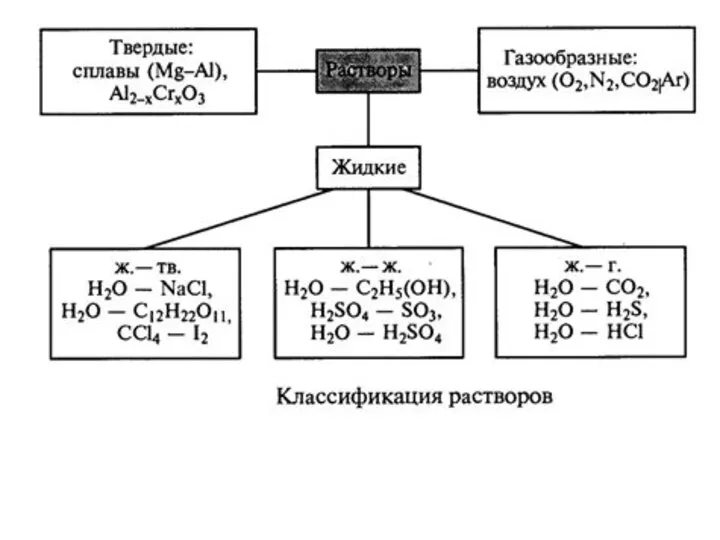
- 6. Термин «раствор» является общим и означает в случае «истинного» раствора распределение и распространение одного вещества в
- 7. Кока – кола = раствор Ж+Т (сахар в воде), Ж+Ж (фосфорная кислота в воде), Ж+Г (диоксид
- 8. Гетерогенные системы, которые содержат границу раздела между введенной в растворитель фазой и самим растворителем, не являются
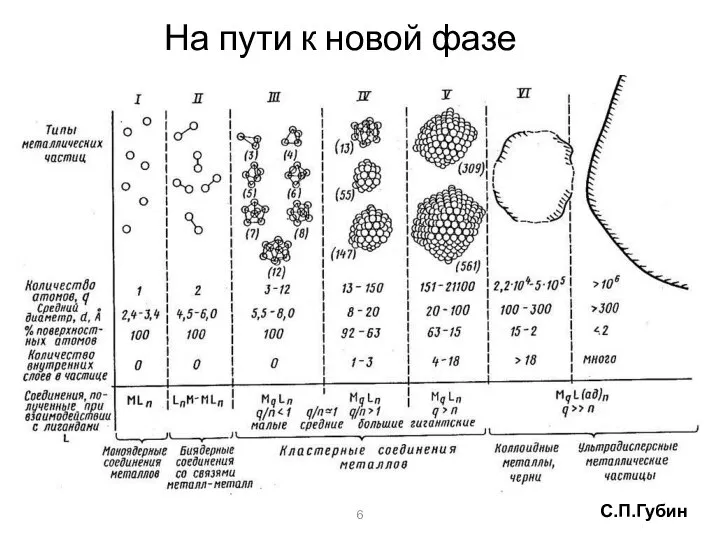
- 9. На пути к новой фазе 6 С.П.Губин
- 11. 8 «Раствор» квантовых точек – золь (наноТ + Ж)
- 13. ✔ Коллоидные системы имеют важное значение в химии, биологии, технологии Истинные растворы полезны тем, что в
- 15. Особенностью твердых растворов, как и любой твердой фазы, является наличие точечных дефектов, содержание которых зависит от
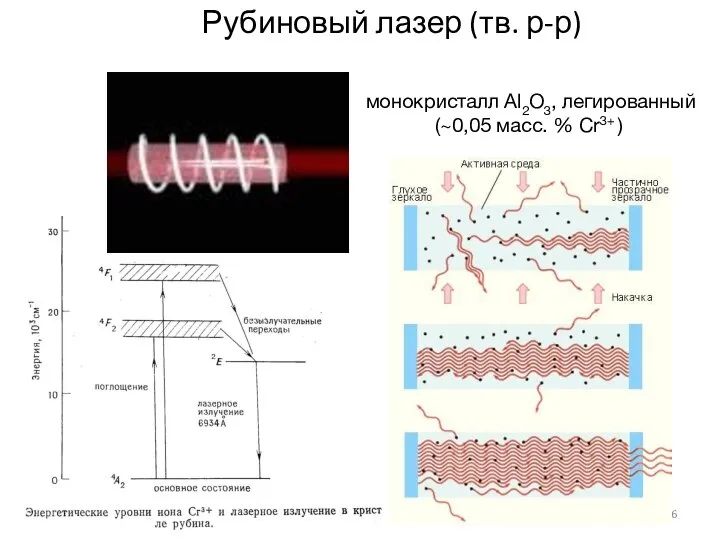
- 16. 6 1 Рубиновый лазер (тв. р-р) монокристалл Аl2О3, легированный (~0,05 масс. % Сr3+ )
- 17. Расплавы на фазовых диаграммах также являются «растворами» одних компонентов в других. При изменении температуры (или других
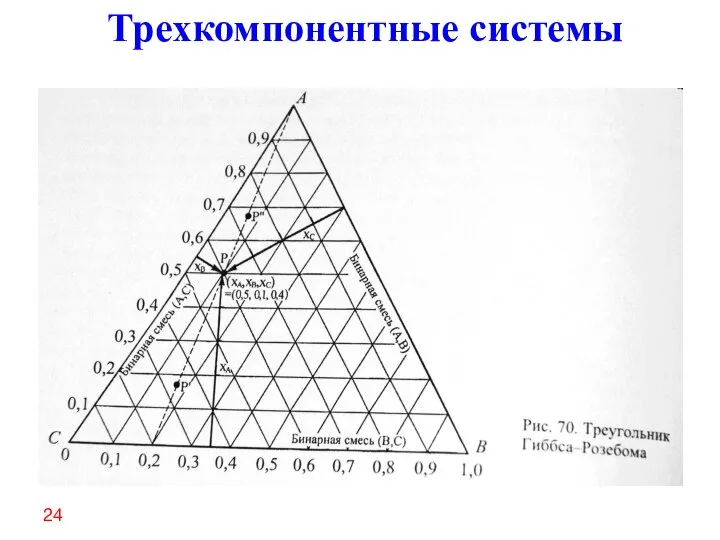
- 22. ✔ Для описания состава фаз, в том числе растворов (расплавов) в трехкомпонентной системе используют набор бинарных
- 23. 24 Трехкомпонентные системы
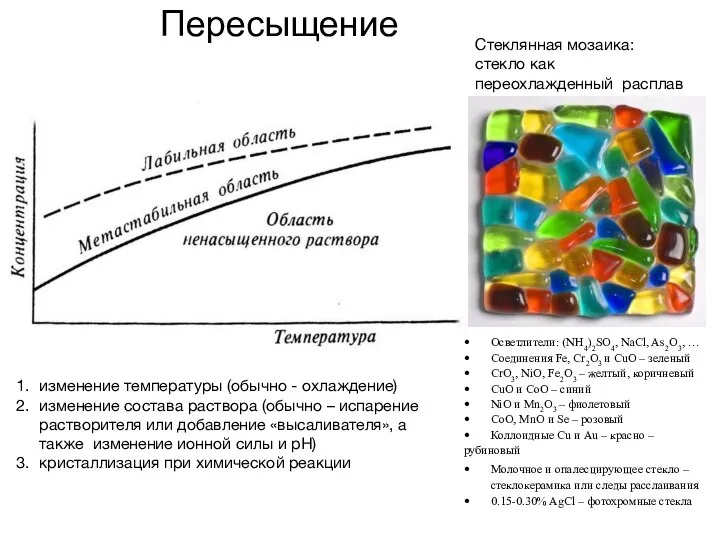
- 25. Пересыщение изменение температуры (обычно - охлаждение) изменение состава раствора (обычно – испарение растворителя или добавление «высаливателя»,
- 26. ✔ Для лабильной системы происходит самопроизвольное выделение второй фазы, например, кристаллизация твердой фазы из жидкого раствора.
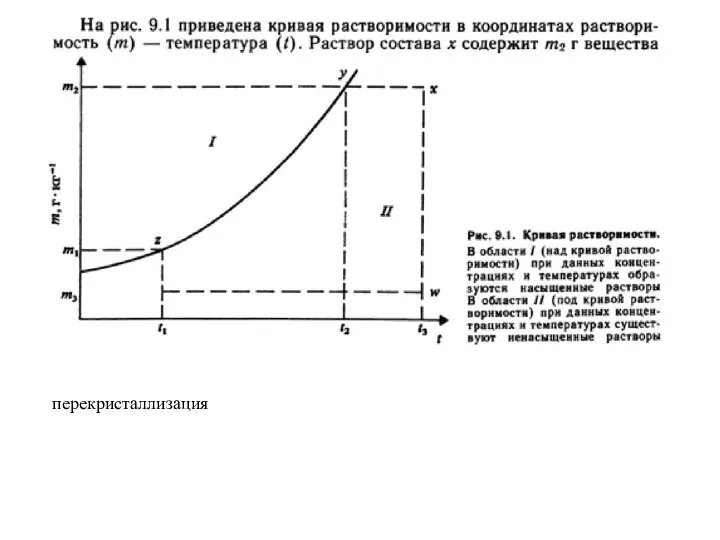
- 27. перекристаллизация
- 28. Из условия задачи и определения растворимости при 60 °С следует: 31,2 г соли растворимо в 68,8
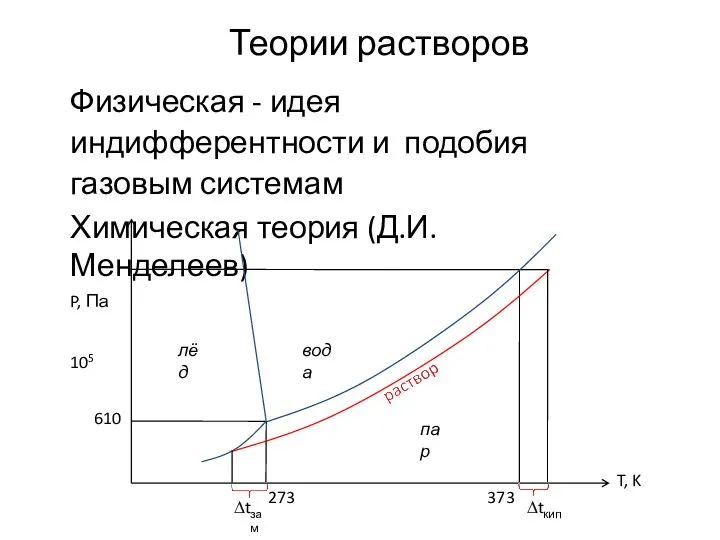
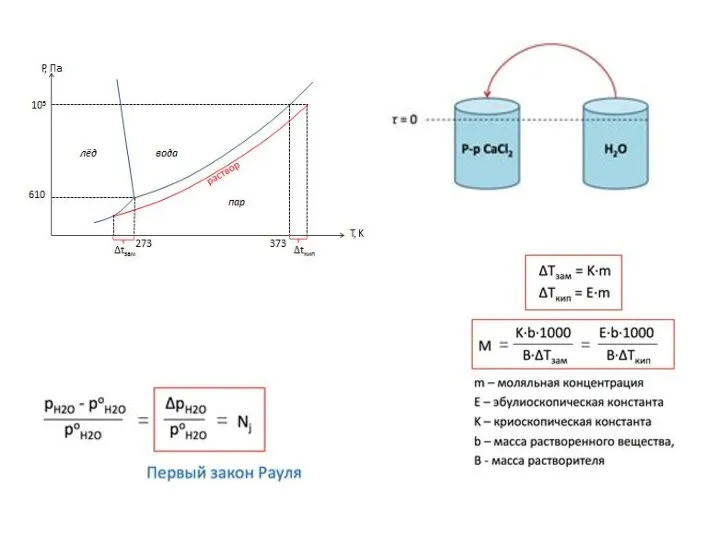
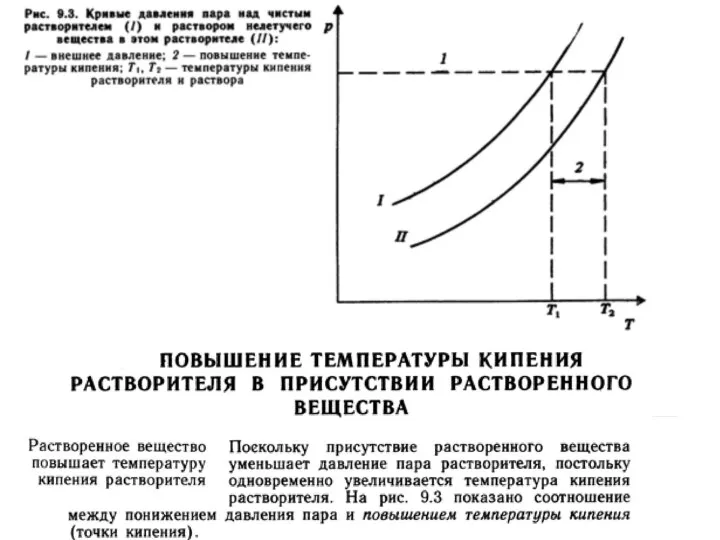
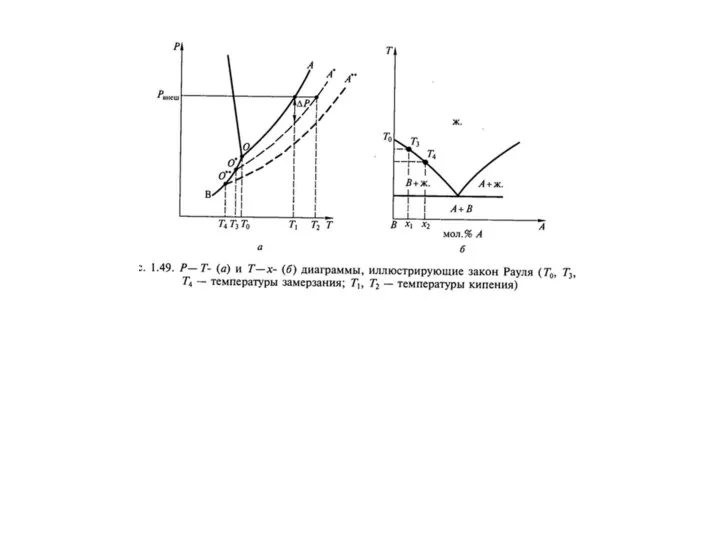
- 29. Теории растворов Физическая - идея индифферентности и подобия газовым системам Химическая теория (Д.И. Менделеев) P, Па
- 30. Идея подобия индифферентным системам типа смесей идеальных газов позволяет оперировать простыми уравнениями состояния и создавать простые
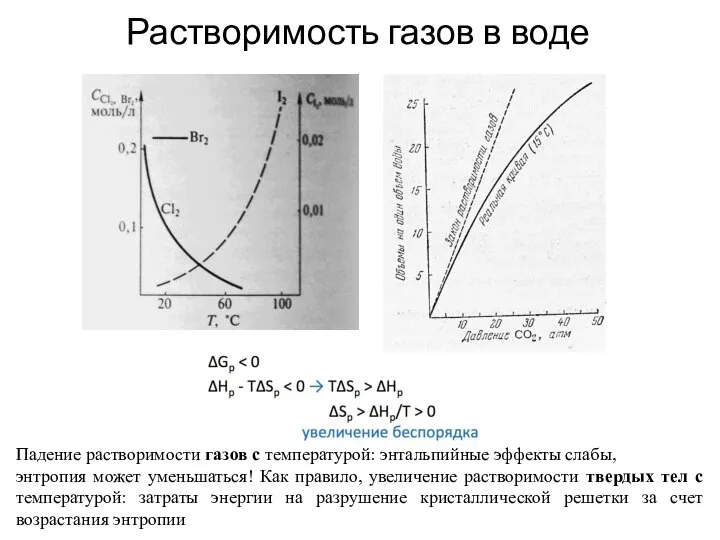
- 31. Растворимость газов в воде Падение растворимости газов с температурой: энтальпийные эффекты слабы, энтропия может уменьшаться! Как
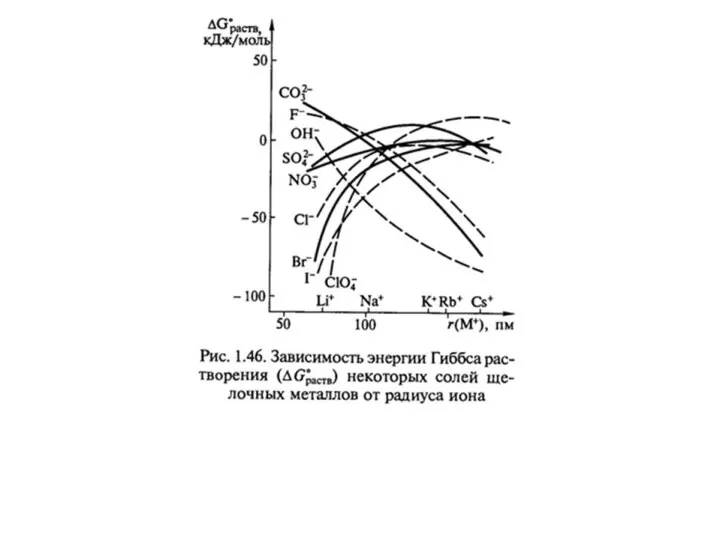
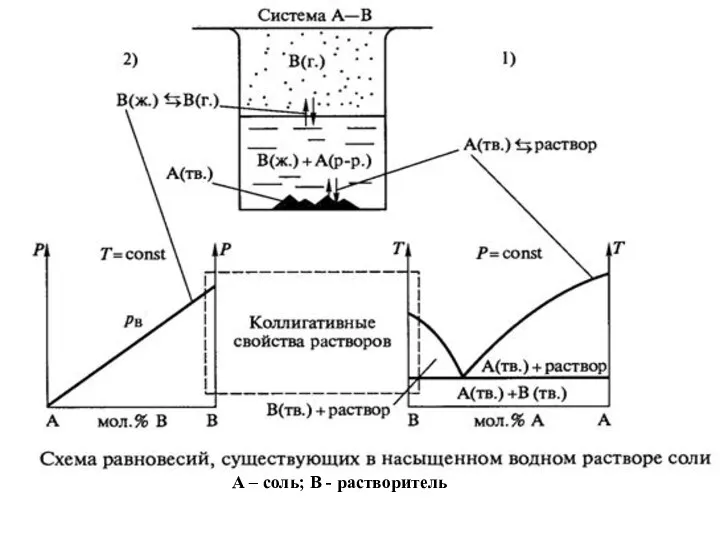
- 34. А – соль; В - растворитель
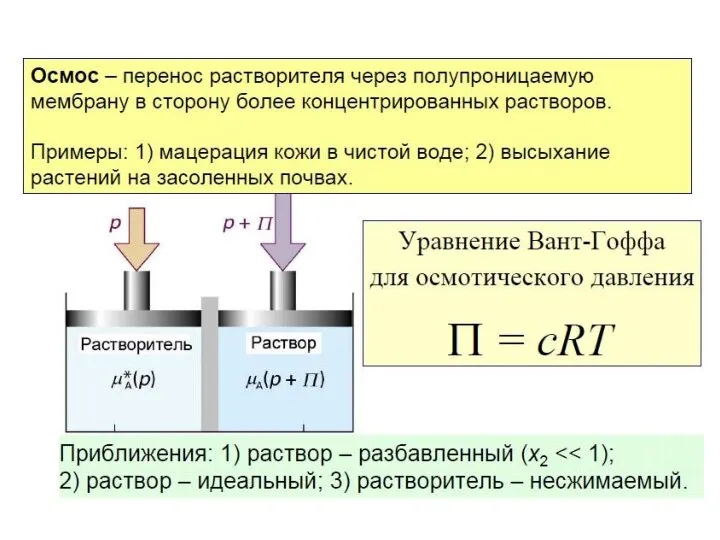
- 50. находится в физиологической среде с уровнем растворенных веществ, иначе определенным осмотическое давление заставит их съежиться или,
- 51. Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для
- 52. Человечество с древних времен, хотя и не понимая физический смысл, использовало эффект осмоса в процессе засаливания
- 53. Прямой (также естественный или обычный) осмос — осмотический процесс, в котором растворитель, отделённый от раствора полупроницаемой
- 54. Раствор – гомогенная фаза переменного состава, формирующаяся при растворении вещества в растворителе, при этом растворяемое вещество
- 58. Скачать презентацию









































 Алюминий
Алюминий Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Циклоалканы
Циклоалканы Неорганические вещества
Неорганические вещества Непредельные углеводороды: алкены и алкины
Непредельные углеводороды: алкены и алкины Висмут Bi
Висмут Bi Нітратна кислота Презентація вчителя хімії Смілянської загальноосвітньої школи І-ІІІ ст. № 11 Л.В.Заруби
Нітратна кислота Презентація вчителя хімії Смілянської загальноосвітньої школи І-ІІІ ст. № 11 Л.В.Заруби Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Углеводороды в природе
Углеводороды в природе Применение углерода
Применение углерода Магний для растений
Магний для растений Презентация на тему Изомерия
Презентация на тему Изомерия  热塑性复合材料的分类及特性
热塑性复合材料的分类及特性 Состояние электронов в атоме
Состояние электронов в атоме Изомерия
Изомерия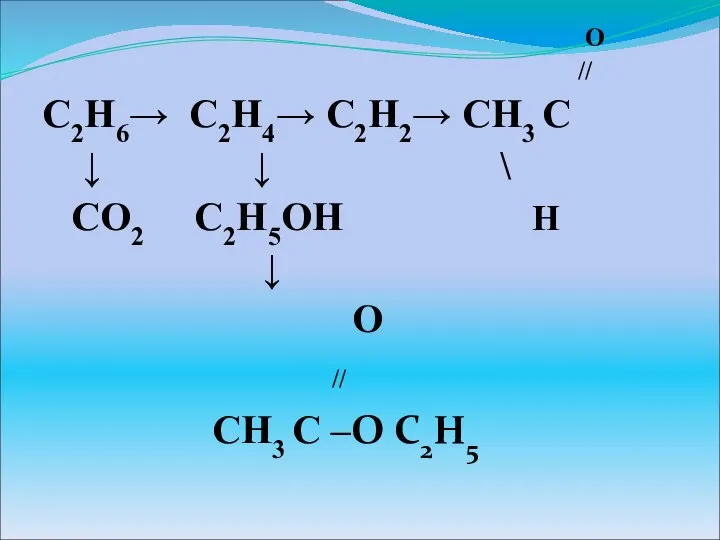 Органические соединения
Органические соединения Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2
Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2 Учебное задание Расчет теплоты сгорания
Учебное задание Расчет теплоты сгорания Карбоновые кислоты
Карбоновые кислоты proekt_TTU_15 (1)
proekt_TTU_15 (1) Оксиды, получение и свойства
Оксиды, получение и свойства Презентация по Химии "Получение уксусной кислоты и опыты с ней"
Презентация по Химии "Получение уксусной кислоты и опыты с ней"  Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Циклические эфиры (окиси)
Циклические эфиры (окиси) Влияние давления на процессы абсорбция и деборция
Влияние давления на процессы абсорбция и деборция Азот в сельском хозяйстве
Азот в сельском хозяйстве