Содержание
- 2. По аналогии с общей характеристикой элементов VIIА группы вспомните и выберите порядок действий: 1.Общая формула и
- 3. Опишите положение элементов халькогенов в Периодической системе химических элементов Д.И. Менделеева. К элементам 6 -А группы
- 4. «Халькогены» Название группы «Халькогены» дословно переводится, как «рождающие руды» от греч. «халькос» – медь и «генос»
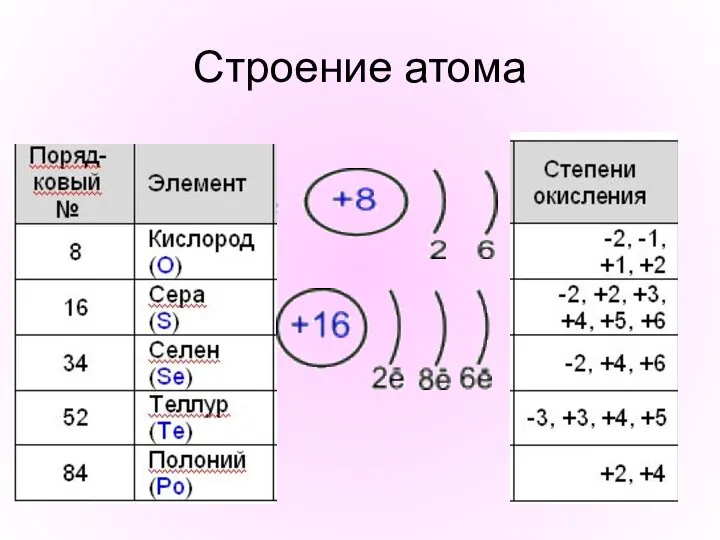
- 5. Строение атома
- 9. КИСЛОРОД Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле;
- 10. Химические свойства О2
- 11. Дополните. Химические свойства О2 Взаимодействие веществ с кислородом называется…?. С кислородом реагируют все элементы, кроме…, во
- 12. Ответ Взаимодействие веществ с кислородом называется окисление. С кислородом реагируют все элементы, кроме Au, Pt, He,
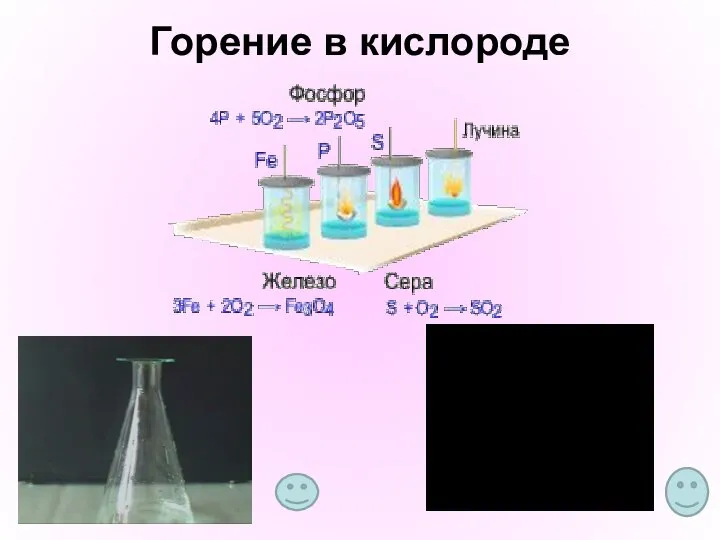
- 13. Горение в кислороде
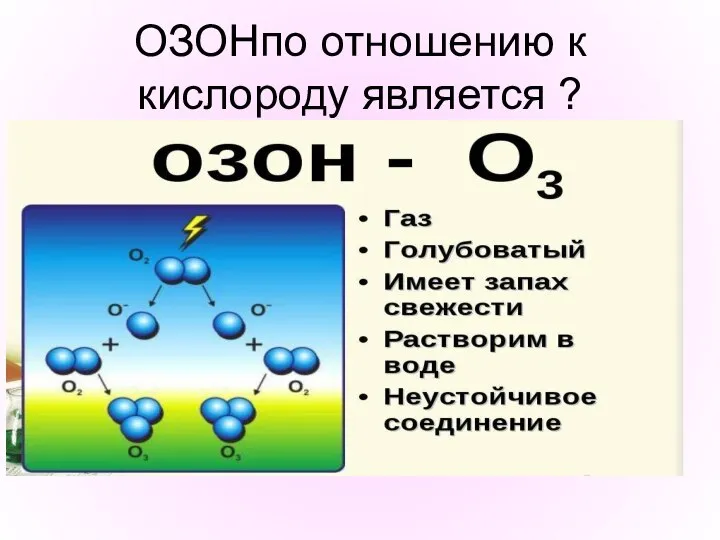
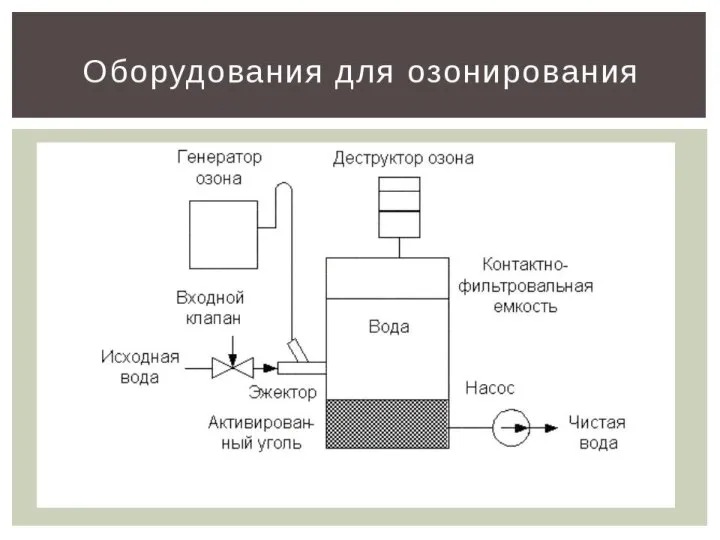
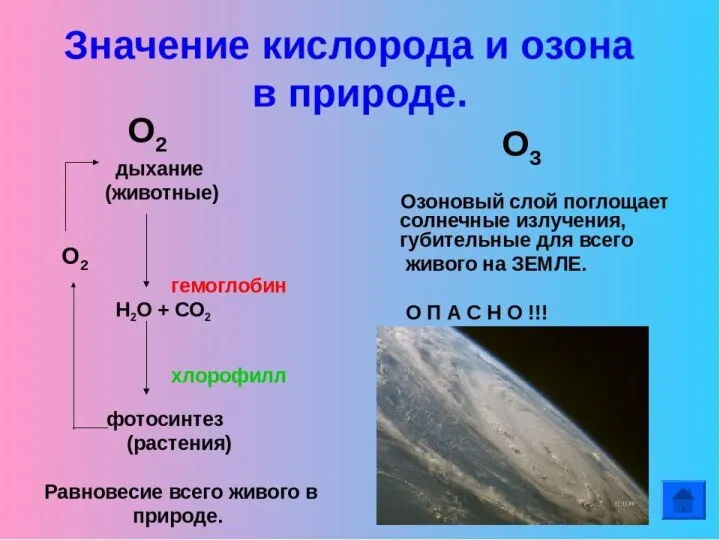
- 14. ОЗОНпо отношению к кислороду является ?
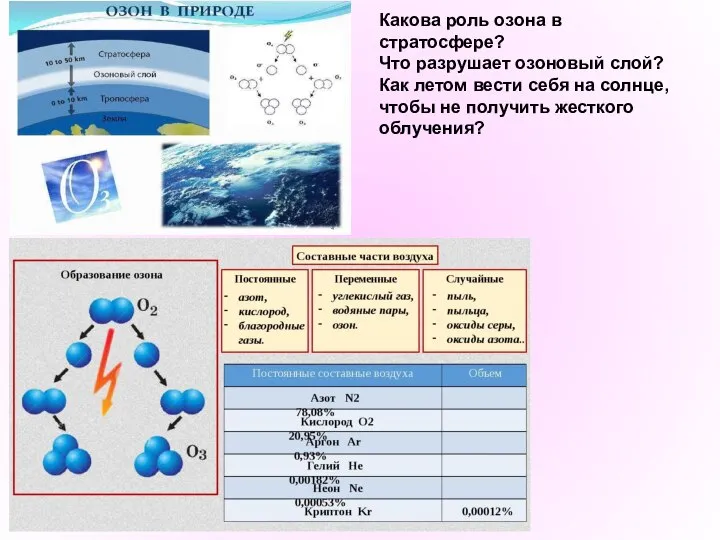
- 15. Какова роль озона в стратосфере? Что разрушает озоновый слой? Как летом вести себя на солнце, чтобы
- 19. СЕРА S Физические свойства - Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается
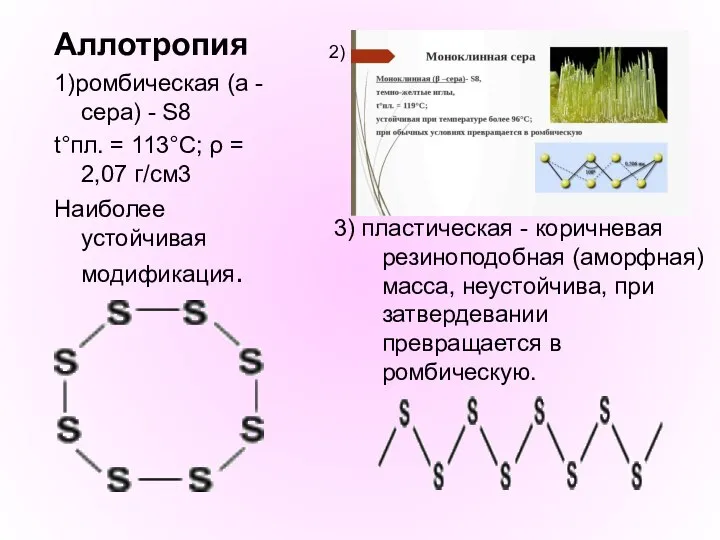
- 20. Аллотропия 1)ромбическая (a - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3 Наиболее устойчивая
- 21. Химические свойства
- 23. Соединения серы Сероводород и сульфиды H2S Оксид серы (IV) SO2 Сернистая кислота H2SO3 Сульфиты и гидросульфиты
- 24. Серная кислота и ее соли H2SO4
- 26. Техника безопасности при работе с серной кислотой Правила ТБ при работе с кислотами Правила разбавления серной
- 27. Свойства разбавленной серной кислоты Серная кислота – сильный электролит, поэтому хорошо диссоциирует в воде на ионы
- 28. Свойства разбавленной серной кислоты С Металлами до Н С основными оксидами С растворимыми основаниями С нерастворимыми
- 30. Скачать презентацию




















 Образование и получение веществ. 6 класс
Образование и получение веществ. 6 класс Стехиометрические законы химии
Стехиометрические законы химии Презентация на тему Металлы в организме человека
Презентация на тему Металлы в организме человека  Сложные эфиры. Жиры
Сложные эфиры. Жиры Презентация на тему Металлическая связь
Презентация на тему Металлическая связь  Экстракционное разделение радионуклидов
Экстракционное разделение радионуклидов Ķīmiskais līdzsvars un faktori, kas to ietekmē
Ķīmiskais līdzsvars un faktori, kas to ietekmē Новое в ЕГЭ. Химия
Новое в ЕГЭ. Химия География. Уральские самоцветы
География. Уральские самоцветы Презентация на тему Типы изомерии
Презентация на тему Типы изомерии  Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Диагностическое тестирование по химии в 8 классе
Диагностическое тестирование по химии в 8 классе Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Презентация по Химии "Металлы в организме человека"
Презентация по Химии "Металлы в организме человека"  Узоры на молоке. Опыт
Узоры на молоке. Опыт Задача 11 Ртутное сердце Команда: Мастера Беспорядка
Задача 11 Ртутное сердце Команда: Мастера Беспорядка Презентация на тему Нанотехнологии в химии
Презентация на тему Нанотехнологии в химии  Сплавы алюминия. Их применение
Сплавы алюминия. Их применение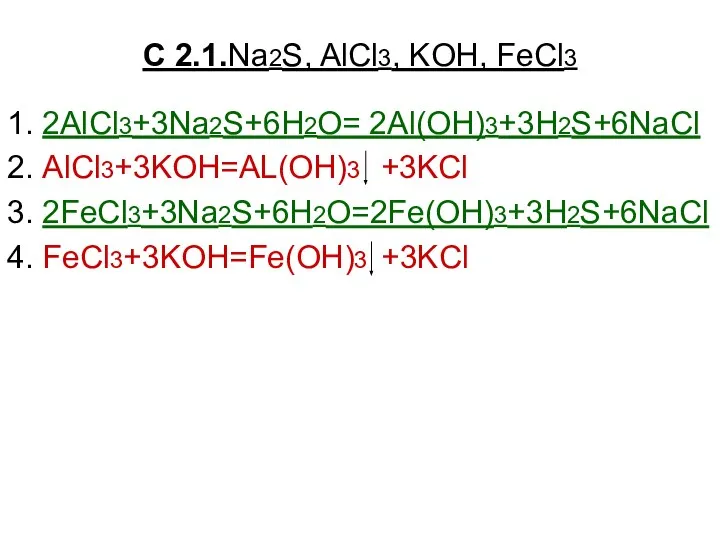 Na2S, AlCl3, KOH, FeCl3
Na2S, AlCl3, KOH, FeCl3 Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Методы анализа структуры белка
Методы анализа структуры белка Основания как электролиты
Основания как электролиты Задача на химическое равновесие
Задача на химическое равновесие Значение химии в медицине
Значение химии в медицине Group 6 Cations
Group 6 Cations Презентация на тему Мусор
Презентация на тему Мусор  Азот N2
Азот N2 Нуклеин қышқылдары
Нуклеин қышқылдары