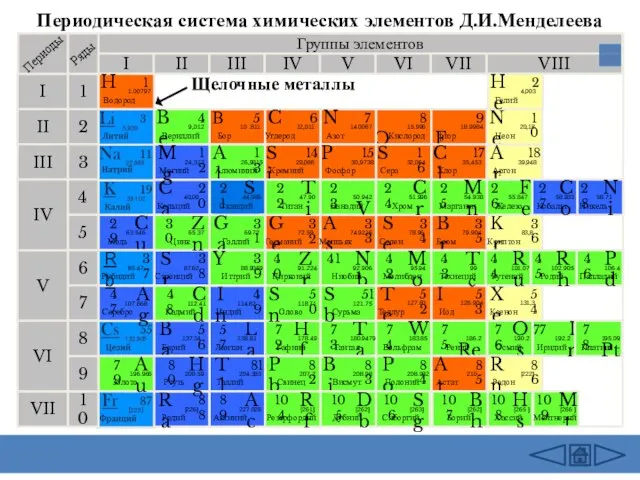
Слайд 2Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
F
фтор
9
18.9984
Br
Бром
35
79.904
I
Иод
53
126.904
Cl
Хлор
17
35,453
At
Астат
85
210
9
8
Щелочные металлы
Слайд 3Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
9
8
Щелочные металлы
Периодическая система химических элементов Д.И.Менделеева
В главной подгруппе:
Число электронов на внешнем
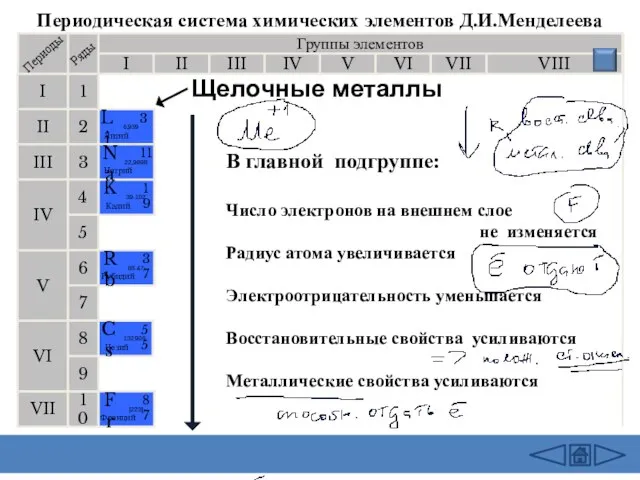
слое
не изменяется
Радиус атома увеличивается
Электроотрицательность уменьшается
Восстановительные свойства усиливаются
Металлические свойства усиливаются
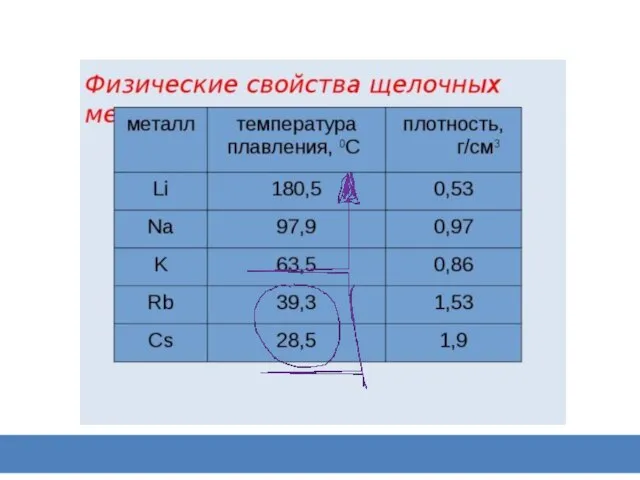
Слайд 10 Химические свойства
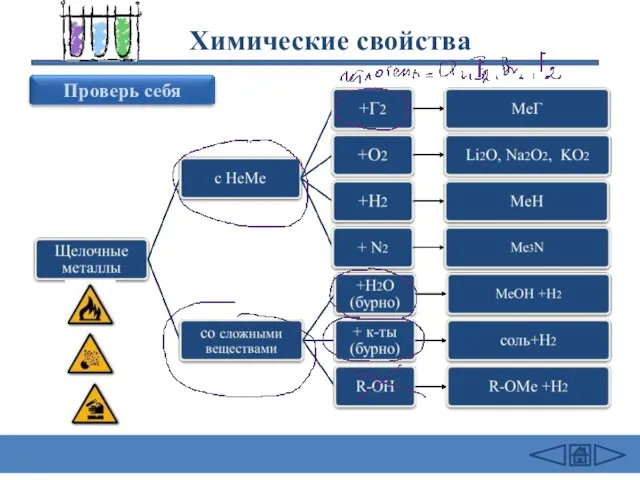
1) 2Na + Cl2 = 2NaCl (в атмосфере F2 и

Cl2 щелочные Me самовоспламеняются)
4Li + O2 = 2Li2O оксид лития
2Na + O2 = Na2O2 пероксид натрия
2K + 2O2 = K2O4 надпероксид калия
Слайд 11 Химические свойства
3) 2Na + Н2 = 2NaН
(при нагревании 200-400oC)
4) 6Li

+ N2 = 2Li3N (Li - при комнатной T, остальные щелочные Me -при нагревании)
Слайд 12 Химические свойства
5) 2Na + 2Н2О = 2NaОН + Н2
(Li -

спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н2
Rb и Cs реагируют не только
с жидкой Н2О, но и со льдом. .
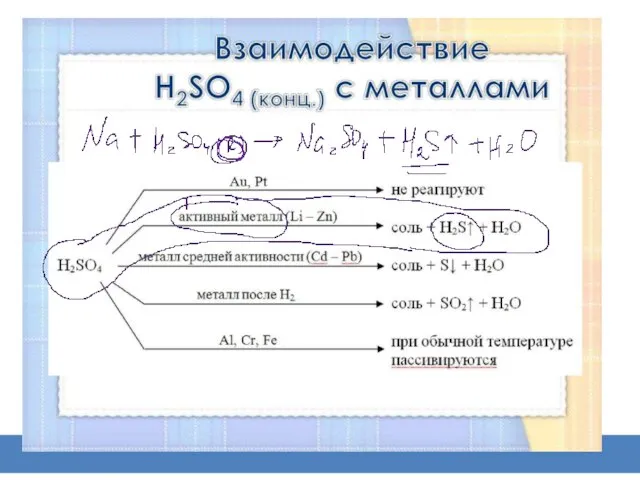
6) 2Na+ Н2SО4 = Na2SО4 + Н2
(протекают очень бурно)
Слайд 13Качественное определение щелочных металлов
Li+ Na+ K+
Для распознавания соединений щелочных металлов по

окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки.
Li+ - карминово-красный K+ - фиолетовый Cs+ - фиолетово-синий
Na+ - желтый Rb + - красный
Слайд 15Составить химические реакции, уравнять методом электронного баланса, указать окислитель и восстановитель.
Li +

H2O = LiOH + H2
K + Cl2 = KCl
Na + HNO3 = NaNO3 + N2O + H2O
Слайд 18Задача 1: Рассчитайте сколько грамм натрия необходимо для его реакции с 46

г соляной кислоты.
Слайд 19Задача 2: Сколько грамм соли образуется в результате взаимодействия 4,5 г калия

с 10 г хлора?















 Надмолекулярные структуры
Надмолекулярные структуры Углерод
Углерод Амины
Амины Витамины и их роль в жизни людей
Витамины и их роль в жизни людей Идеальная химическая лаборатория в школе
Идеальная химическая лаборатория в школе Классификация органических соединений. 10 класс
Классификация органических соединений. 10 класс Кремний и его соединения
Кремний и его соединения Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Алкены
Алкены Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Закалка без полиморфного превращения
Закалка без полиморфного превращения Неметаллические материалы
Неметаллические материалы Коллоидная химия
Коллоидная химия Применения химического анализа людьми в разных родах занятий
Применения химического анализа людьми в разных родах занятий Сплавы на основе магния и титана
Сплавы на основе магния и титана Приходченко ФЕР-2031
Приходченко ФЕР-2031 Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері
Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері Буферлік жүйелер мен ерітінділер туралы түсініктер, олардың құрамы және жіктелуі
Буферлік жүйелер мен ерітінділер туралы түсініктер, олардың құрамы және жіктелуі Физико-химические методы анализа. Лекция 4
Физико-химические методы анализа. Лекция 4 8-29 класс (1)
8-29 класс (1) Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М
Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М Экстракция и кристаллизация
Экстракция и кристаллизация Смолисто-асфальтеновые вещества
Смолисто-асфальтеновые вещества Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Cиликат кальция
Cиликат кальция Альдегиды. Свойства альдегидов
Альдегиды. Свойства альдегидов Химическая коррозия
Химическая коррозия Химические структуры
Химические структуры