Содержание
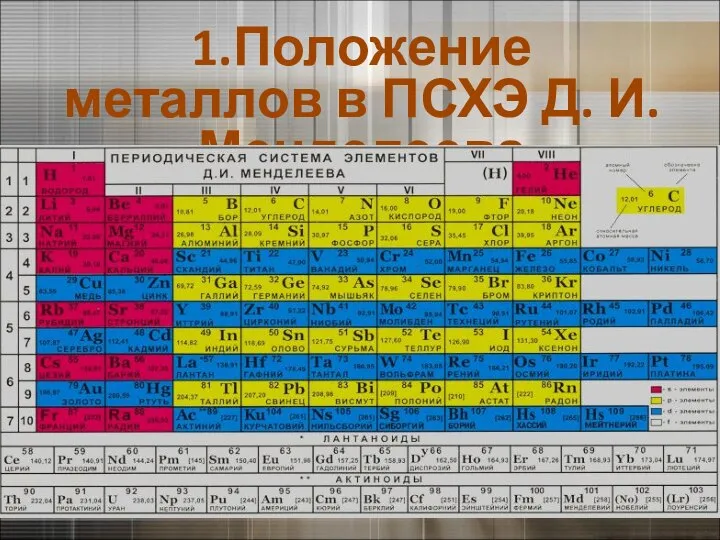
- 2. 1.Положение металлов в ПСХЭ Д. И. Менделеева
- 3. 1.Положение металлов в ПСХЭ Д. И. Менделеева
- 4. В группах: металлические свойства усиливаются причина: 1.увеличивается заряд ядра, 2.число электронов на внешнем не изменяется 3.радиус
- 5. 1.Положение металлов в ПСХЭ Д. И. Менделеева К элементам - металлам относятся: s - элементы I
- 6. 2.Строение атомов металлов и веществ металлов Из положения в таблице Д.И. Менделеева следует: Атомы металлов на
- 7. 2. У атомов металлов большие размеры атомных радиусов. Поэтому металлы легко отдают внешние электроны. Металлы в
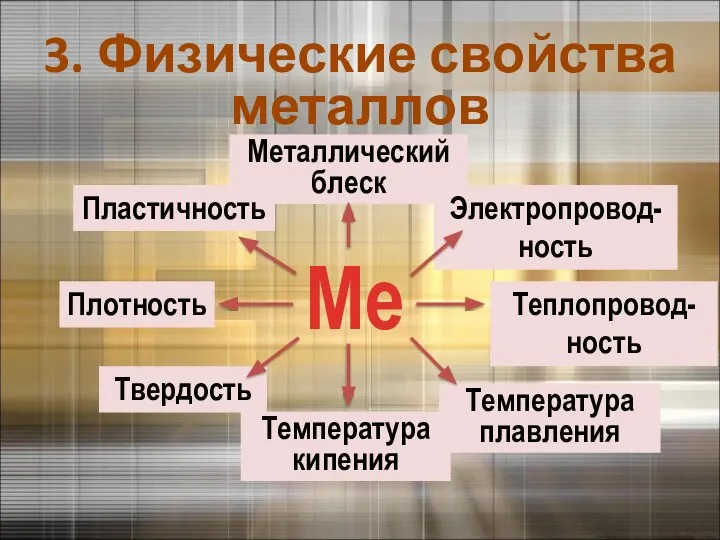
- 8. Температура плавления Ме Металлический блеск Теплопровод-ность Электропровод-ность Температура кипения Твердость Плотность Пластичность 3. Физические свойства металлов
- 9. 3. Физические свойства металлов 1. Металлический блеск Самые блестящие металлы – Hg, Ag, Pd. В порошке
- 11. 3. Физические свойства металлов Наименьшая электропроводность в ряду: Mn → Pb → Hg. В ряду: Ag→Cu
- 13. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической
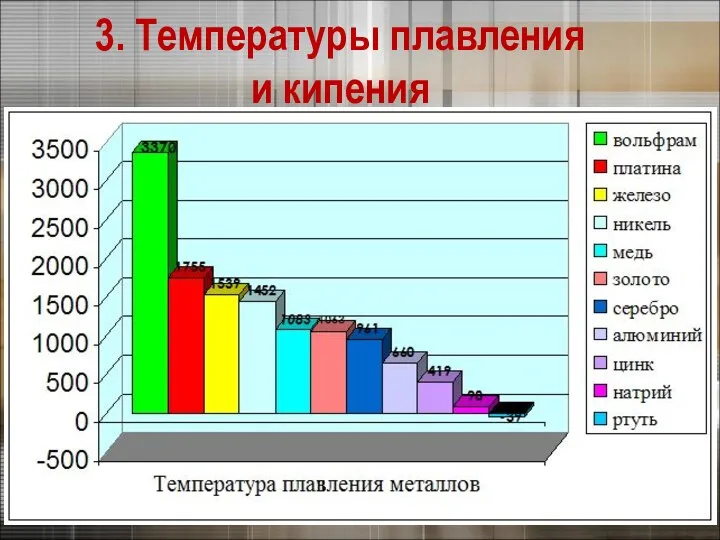
- 14. 3. Физические свойства металлов 3. Температуры плавления и кипения Калий Вольфрам Ртуть
- 15. 3. Температуры плавления и кипения
- 16. Нить накаливания
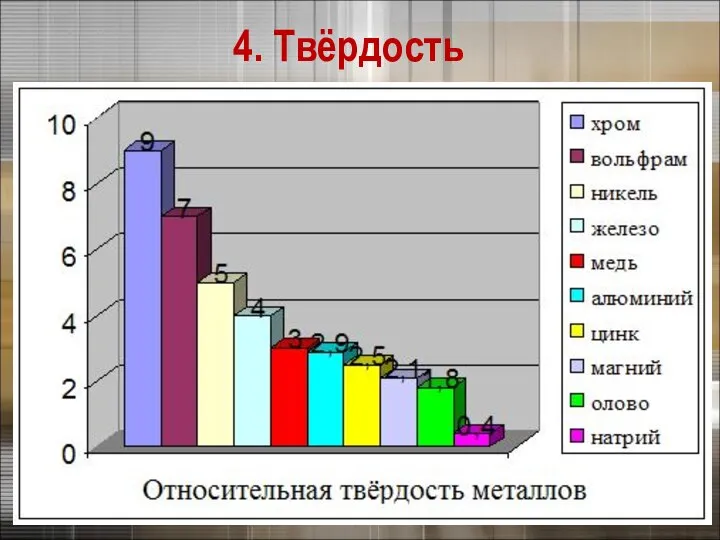
- 17. 3. Физические свойства металлов 4. Твёрдость Щелочные металлы режутся ножом
- 18. 4. Твёрдость
- 19. Хром – самый твёрдый металл
- 20. 4. Твёрдость Самый твердый – хром (режет стекло). Самые мягкие – щелочные металлы – калий, натрий,
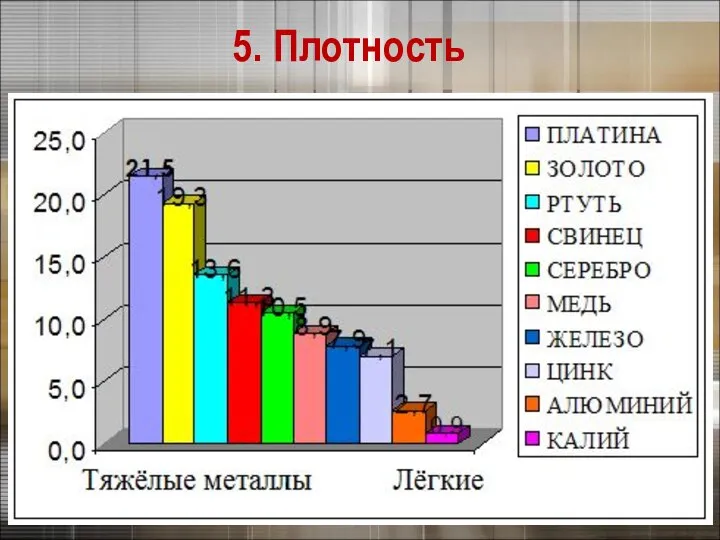
- 21. Плотность тем меньше, чем меньше атомная масса металла и чем больше радиус его атома 5. Плотность
- 22. 5. Плотность
- 23. Самый легкий – литий (ρ =0,53 г/см3), всплывает в керосине. Самый тяжелый – осмий (ρ =22,6
- 24. Литий – самый лёгкий металл
- 25. Осмий – самый тяжёлый металл Осмий – самый дорогой металл (изотоп 187)
- 26. 6. Пластичность Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы.
- 27. Сусальное золото
- 29. Скачать презентацию





















 Кислоты: состав, классификация, номенклатура, получение
Кислоты: состав, классификация, номенклатура, получение Химический состав клетки
Химический состав клетки Типы химических реакций
Типы химических реакций Презентация на тему ИКТ на уроках химии
Презентация на тему ИКТ на уроках химии  Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Синтез.Малахит
Синтез.Малахит Дисперсные системы
Дисперсные системы Искусство фотографии и химия
Искусство фотографии и химия Zirconium Dioxide
Zirconium Dioxide Презентация на тему Белки
Презентация на тему Белки  Классификация химических реакций
Классификация химических реакций Кислоты в химии
Кислоты в химии Неметаллы. 8 класс
Неметаллы. 8 класс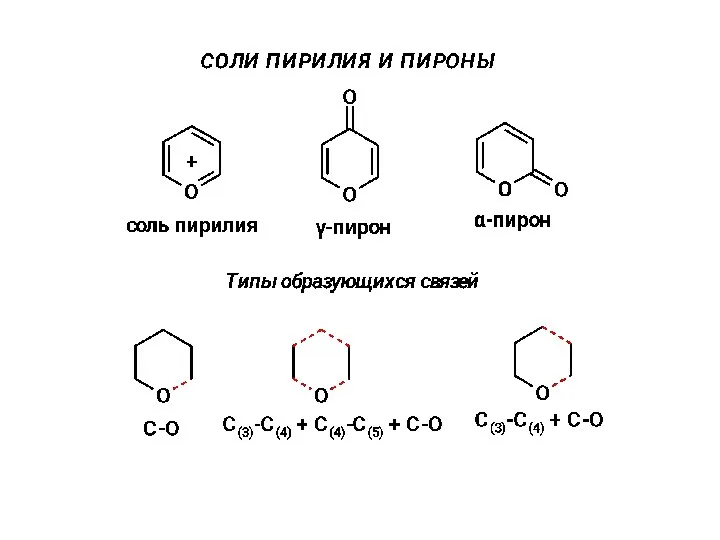 Соли пирилия и пироны
Соли пирилия и пироны Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения
Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6
Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6 Основы МКТ
Основы МКТ Презентация на тему Соли аммония
Презентация на тему Соли аммония  Силикаты
Силикаты Менделеевский период
Менделеевский период Мило. Його склад. Мийна дія
Мило. Його склад. Мийна дія Классификация оксидов по химическим свойствам
Классификация оксидов по химическим свойствам Химический элемент титан
Химический элемент титан Хімія у вирішенні промислової проблеми
Хімія у вирішенні промислової проблеми Молекулярно-кинетическая теория. Макро- и микропараметры
Молекулярно-кинетическая теория. Макро- и микропараметры Осмотическое давление
Осмотическое давление Гідроліз солей
Гідроліз солей Массовые доли растворенного вещества
Массовые доли растворенного вещества