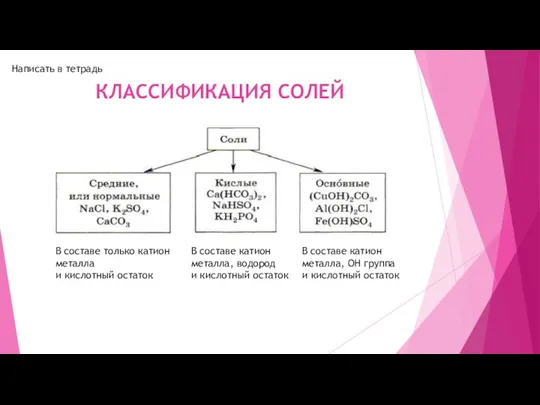
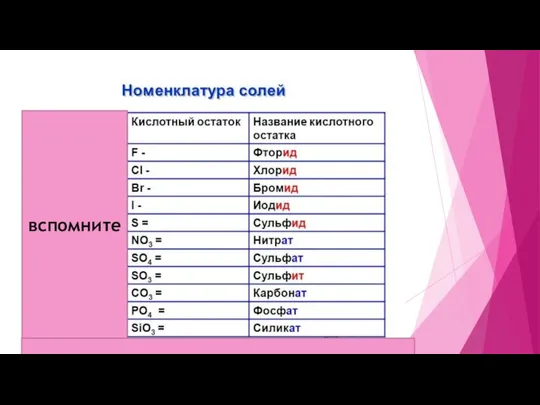
КИСЛОТА (реакция обмена)
! Обязательно в результате реакции должен образоваться либо осадок (нерастворимое вещество), либо газ
-Na2CO3+ 2HCl=2NaCl+ H2CO3 (H2O +CO2) Так как образовался газ, то реакция идёт
ВСПОМНИТЕ, ЧТО есть 2 кислоты, которые неустойчивые и распадаются - H2CO3 (распадается на H2O и CO2 ( углекислый газ)) и H2SO3 – (распадается на H2O и SO2 ( сернистый газ))
-AgNO3+HBr------>AgCl(нерастворимая)+HNO3 Так как образовалось нерастворимое вещество, т.е осадок, то реакция идёт
-KBr+HNO3-----> реакция не протекает, так как все образовавшиеся вещества растворимые ( см. таблицу растворимости) и устойчивые ( выше прописано, какие 2 кислоты неустойчивые)
Написать






 Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Презентация на тему ОВР в органической химии
Презентация на тему ОВР в органической химии  Презентация на тему Золото
Презентация на тему Золото  Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения  Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Физика полимеров Ч1
Физика полимеров Ч1 Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Процесс образования неметаллических включений в стали
Процесс образования неметаллических включений в стали Строение электронных оболочек атомов
Строение электронных оболочек атомов Круговорот серы в природе
Круговорот серы в природе Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции Французский физик, химик, металловед 1850 - 1936
Французский физик, химик, металловед 1850 - 1936 Что такое электрон?
Что такое электрон? Бериллий, магний и щелечноземельные металлы
Бериллий, магний и щелечноземельные металлы Строение материалов. Дефекты кристаллической структуры
Строение материалов. Дефекты кристаллической структуры Алкены
Алкены Ионные равновесия в растворах
Ионные равновесия в растворах Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Презентация на тему Ковалентная химическая связь
Презентация на тему Ковалентная химическая связь  Природные источники углеводородов
Природные источники углеводородов Металлы
Металлы Презентация на тему Йод
Презентация на тему Йод  Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Тепловой эффект
Тепловой эффект Презентация на тему Углерод
Презентация на тему Углерод 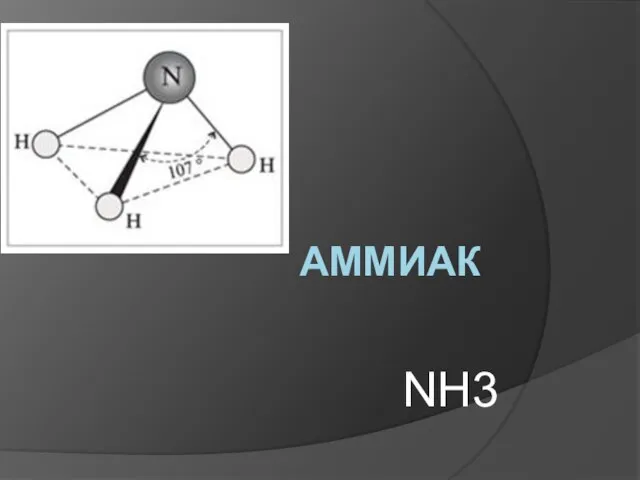 Аммиак NH3
Аммиак NH3 Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота