Слайд 2Основные понятия химии
В химических расчетах используется единица количества вещества – моль. Один

моль любого вещества содержит число Авогадро (NA=6,02⋅1023) частиц, из которых оно состоит.
Масса одного моль вещества называется молярной массой (М)
Слайд 54.1. Закон сохранения массы и энергии: (Ломоносов, 1748)
Масса веществ, вступающих в реакцию

равна массе веществ, образовавшихся в результате реакции:
Ca + Cl2 → CaCl2
40 + 71 = 111
М.В. Ломоносов связывал закон сохранения массы веществ с законом сохранения энергии. Взаимодействие массы и энергии выражается уравнением А. Эйнштейна: E=mc2 ; c=3 ⋅ 108 m/c.
Современная формулировка:
В изолированной системе сумма масс (энергий) веществ до химической реакции равна сумме масс (энергий) образовавшихся веществ после реакции.
Слайд 8Закон постоянства состава (Пруст, 1808)
Любое сложное вещество молекулярного строение независимо от способа

получения имеет постоянный качественный и количественный состав. В природе существуют вещества с молекулярной и кристаллической (ионной) структурой: вещества с постоянным составом – дальтониды (H2O; CO2);
вещества переменного состава – бертоллиды (от TiO0,7 до TiO1,3).
Слайд 9 Закон Авогадро
В равных объёмах различных газов при одинаковых условиях (p,t) содержится

одинаковое число молекул.
Следствие 1: Один моль любого газа в нормальных условиях занимает объём
22,4 л/моль – Vм молярный объём.
Н.у. : p = 1 атм ; 101 кПа, T = 0° С; 273 °К.
Следствие 2: Отношение плотностей двух газов прямо пропорционально отношению их молярных масс: ρ1/ ρ2 = М1/ М2 = D;
D(H2) = M(газа)/2 ; D(возд.) = M (газа)/29
Слайд 13Закон Менделеева – Клапейрона
pV = nRT ; R = 8,314; если р

= Па, V=м3;
R=0,082; если р =атм, V=л.
Объединённый газовый закон.
P ⋅ V = P0 ⋅ V0
T T0














 Конструкционные и функциональные материалы: конструкционные материалы. Введение
Конструкционные и функциональные материалы: конструкционные материалы. Введение Минерал гранат
Минерал гранат Материалы, изменившие мир
Материалы, изменившие мир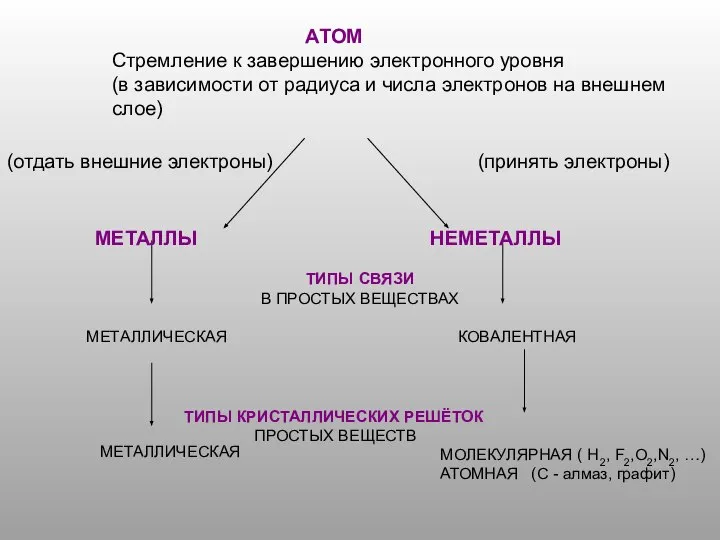 Атом. Стремление к завершению электронного уровня
Атом. Стремление к завершению электронного уровня Презентация на тему Основные классы неорганических соединений
Презентация на тему Основные классы неорганических соединений  Конкурс юных химиков
Конкурс юных химиков Соединения азота в атмосфере. Лекция 4
Соединения азота в атмосфере. Лекция 4 Путешествие в мир кислот
Путешествие в мир кислот Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Презентация на тему Классификация химических реакций (11 класс)
Презентация на тему Классификация химических реакций (11 класс)  Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Бордос сұйықтығын дайындау және оның сапасын тексеру
Бордос сұйықтығын дайындау және оның сапасын тексеру 9. Потомки светоносного элемента
9. Потомки светоносного элемента Металлы и их соединения. Решение экспериментальных задач
Металлы и их соединения. Решение экспериментальных задач Реакции обмена
Реакции обмена Строение воды
Строение воды Квантовая химия
Квантовая химия Строение атома
Строение атома ЛК 2_окислительно-восстановительные процессы
ЛК 2_окислительно-восстановительные процессы Электролитическая диссоциация. Урок химии в 8 классе
Электролитическая диссоциация. Урок химии в 8 классе Растворы, растворимость
Растворы, растворимость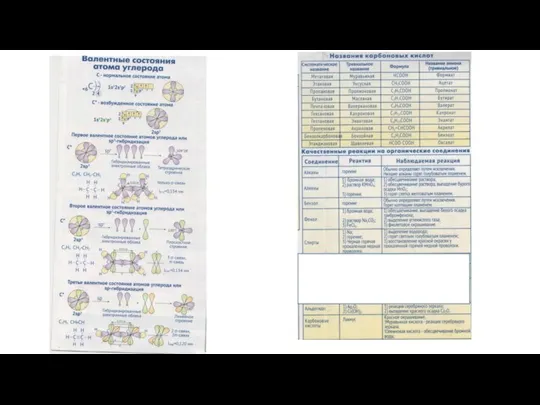 Валентные состояния атома углерода
Валентные состояния атома углерода Неметаллы
Неметаллы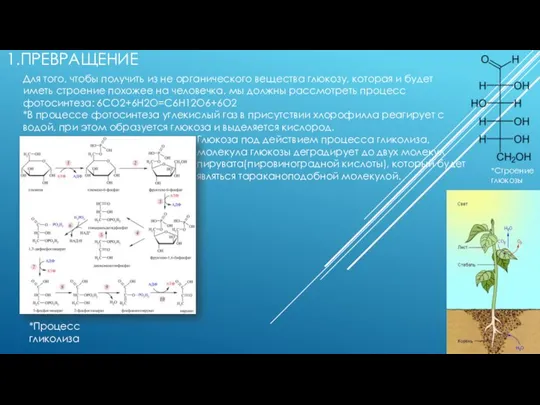 Превращение из не органического вещества в глюкозу
Превращение из не органического вещества в глюкозу Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Цикл Кребса
Цикл Кребса Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела
Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела