Содержание
- 2. medkrmu.kz ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания об основах химической термодинамики, первом законе термодинамики и законе Гесса.
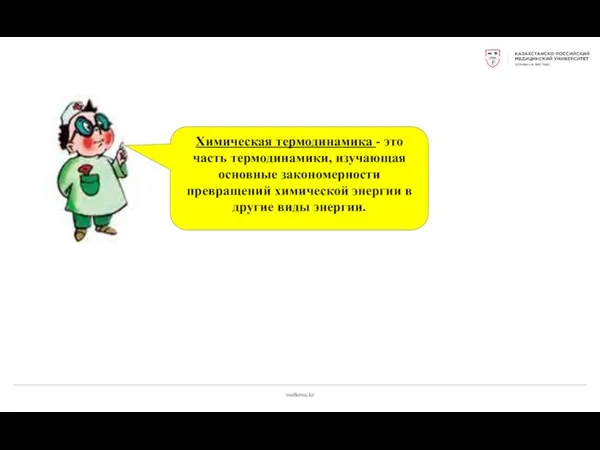
- 3. medkrmu.kz Химическая термодинамика - это часть термодинамики, изучающая основные закономерности превращений химической энергии в другие виды
- 4. medkrmu.kz Основные понятия и термины Термодинамическая система (ТД система) – это тело или совокупность взаимодействующих тел
- 5. medkrmu.kz Классификация систем по характеру взаимодействия с окружающей средой Открытая система (живой организм) Закрытая система (запаянная
- 6. medkrmu.kz Основные понятия химической термодинамики Фаза - это часть системы, отделенная от других частей границей раздела,
- 7. medkrmu.kz Основные понятия химической термодинамики В зависимости от фазового состояния различают: 1. Гомогенные системы. Это системы,
- 8. medkrmu.kz Основные понятия химической термодинамики Термодинамическое состояние системы - совокупность всех физических и химических свойств системы.
- 9. medkrmu.kz Основные понятия химической термодинамики Термодинамические параметры - это совокупность физических величин, определяющих состояние системы: масса
- 10. medkrmu.kz Основные понятия химической термодинамики Термодинамический процесс - переход системы из одного состояния в другое, сопровождающийся
- 11. medkrmu.kz Первый закон термодинамики Химические процессы сопровождаются изменением энергии.
- 12. medkrmu.kz Первый закон термодинамики Является количественным выражением всеобщего закона природы о вечности материи и движения: энергия
- 13. medkrmu.kz Функции состояния системы Энтальпия - это функция состояния системы, характеризующая энергосодержание системы в изобарно-изотермических условиях,
- 14. medkrmu.kz Закон Гесса Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической
- 15. medkrmu.kz Второй закон термодинамики Теплота не может переходить самопроизвольно от более холодного тела к более нагретому
- 16. medkrmu.kz Функции состояния системы Энтропия (по Клаузиусу) - функция состояния система, приращение которой (ΔS) равно минимальной
- 17. medkrmu.kz Функции состояния системы Энтропия связана с вероятностью состояния системы уравнением Больцмана: S=КБ · InW, где
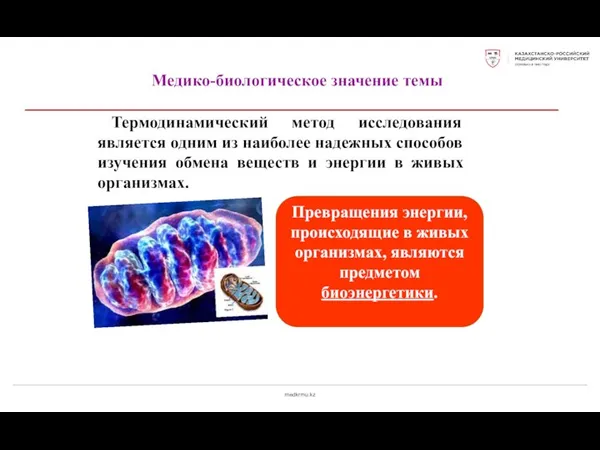
- 18. medkrmu.kz Медико-биологическое значение темы Термодинамический метод исследования является одним из наиболее надежных способов изучения обмена веществ
- 19. medkrmu.kz Особенности организации живых систем: Биологические системы являются открытыми. Процессы в живых системах в конечном итоге
- 20. medkrmu.kz Биоэнергетика Термодинамический смысл смерти живого организма – это равновесное состояние, характеризующееся отсутствием потоков энергии и
- 22. Скачать презентацию

















 Железо в продуктах питания
Железо в продуктах питания Теория электролитической диссоциации
Теория электролитической диссоциации 897386 (2)
897386 (2) Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории Альдегиды. Состав. Строение. Свойства. Применение
Альдегиды. Состав. Строение. Свойства. Применение Окислительно-восстановительные реакции. Классификация ОВР
Окислительно-восстановительные реакции. Классификация ОВР Химия и космос
Химия и космос Закон постоянства состава веществ. Химические формулы. (8 класс)
Закон постоянства состава веществ. Химические формулы. (8 класс) Кислородосодержащие органические соединения. Cпирты (алканолы)
Кислородосодержащие органические соединения. Cпирты (алканолы) Химический элемент кислород
Химический элемент кислород Лакокрасочные материалы
Лакокрасочные материалы Положительно (+) заряженные частицы. Катионы
Положительно (+) заряженные частицы. Катионы Алюминий
Алюминий Cкорость химических реакций
Cкорость химических реакций Кислоты в химии
Кислоты в химии Pастворы, используемые в промышленности
Pастворы, используемые в промышленности Типичные реакции оснований
Типичные реакции оснований Искусственные полимеры
Искусственные полимеры Ароматические углеводороды
Ароматические углеводороды Органическая химия
Органическая химия атомно-молекулярное учение (1)
атомно-молекулярное учение (1) Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз
Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз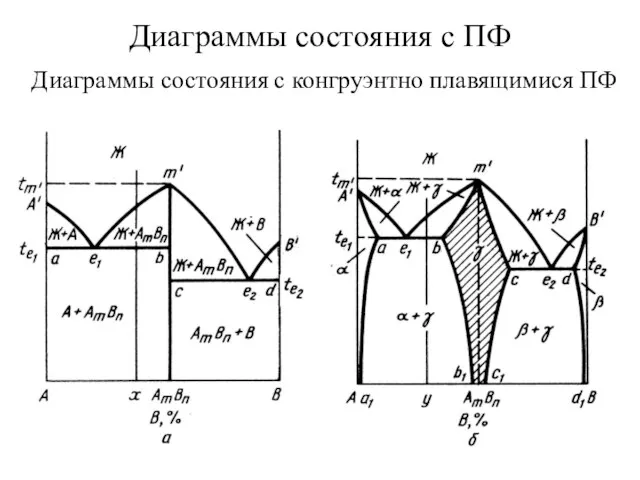 Диаграммы состояния с ПФ. Диаграммы состояния с конгруэнтно плавящимися ПФ
Диаграммы состояния с ПФ. Диаграммы состояния с конгруэнтно плавящимися ПФ Увлекательный мир химии
Увлекательный мир химии Ar, Mr
Ar, Mr Теория валентных связей
Теория валентных связей Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации