Содержание
- 2. Окисление-восстановление − это единый, взаимосвязанный процесс. Окисление соответствует увеличению степени окисления элемента, а восстановление − ее
- 3. Оно может быть применено к некоторым простым ионам типа: Для изменения степени окисления атомов в сложных
- 4. Атом, находящийся в высшей степени окисления, может быть только окислителем, если он находится в низшей степени
- 5. 12.1.1.2 Уравнивание окислительно-восстановительных реакций. Два наиболее распространенных метода составления уравнений для реакций окисления-восстановления. 1. Метод баланса
- 6. 2. Метод полуреакций. В тех случаях, когда реакция протекает в водном растворе (расплаве), при составлении уравнений
- 7. Уравняв их по количеству атомов каждого вида, полуреакции складывают, умножив каждую на такой коэффициент, который уравнивает
- 8. KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O . Записываем реакцию
- 9. MnO4− + 8H+ + 5ē → Mn2+ + 4H2O Находим разницу зарядов продуктов и реагентов: Δq
- 10. Умножая члены первого уравнения на 2, а второго − на 5 и складывая их, получим ионно-молекулярное
- 11. Если в окислительно-восстановительной реакции участвует пероксид водорода (Н2О2), надо учитывать роль Н2О2 в конкретной реакции. В
- 12. 12.1.1.3. Типы окислительно-восстановительных реакций Различают четыре типа окислительно-восстановительных реакций: Межмолекулярные окислительно-восстановительные реакции, при которых изменяются степени
- 13. 3. Реакции самоокисления-самовосстановления В этом случае степень окисления одного и того же элемента и повышается, и
- 14. 12.1.1.4. Эквиваленты окислителей и восстановителей При вычислении эквивалентов элементов и их соединений уже указывалось, что их
- 15. Например, действуя в качестве восстановителя, HI окисляется солями железа (III) до элементарного йода по реакции 2HI
- 16. 12.2. Электрохимические устройства и процессы Электрохимические процессы лежат в основе целого ряда важнейших производств, связанных с
- 17. Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником
- 18. Электрохимические реакции являются гетерогенными процессами, так как протекают на границе раздела фаз (например, металл – вода
- 19. 12.2.1 Электродные потенциалы. Так как окислительно-восстановительные реакции сопровождаются переносом заряда, то их можно осуществлять действием электрического
- 20. Этот скачок называется электродным потенциалом данного металла. Указанное равновесие выражается уравнением, учитывающим гидратацию иона: Ме +
- 21. Стандартный водородный электрод состоит из сосуда с 1н. раствором кислоты, в которую опущен платиновый электрод, контактирующий
- 22. Платина используется вследствие ее инертности, а также потому, что она является катализатором переноса электрона (процесс установления
- 23. Стандартные электродные потенциалы ϕ0 некоторых металлов (ряд напряжения) Стандартный электродный потенциал является количественной характеристикой химической активности
- 24. Основные свойства ряда напряжения. 1. Чем меньше величина ϕ, тем сильнее выражена восстановительная активность металла. 2.
- 25. Если в приведенном уравнении заменить постоянные числовыми значениями, то оно примет следующий вид: Из формулы Нернста
- 26. 12.2.2. Гальванический элемент Даниэля−Якоби Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно
- 27. Медно-цинковый гальванический элемент: (1 − цинковый электрод − анод; 2 − медный электрод − катод; 3
- 28. На поверхности цинковой пластинки устанавливается равновесие Zn Zn2+ + 2ē, которому соответствует потенциал ϕ0 = −0,76
- 29. Устройства, в которых на электродах самопроизвольно протекают окислительно-восстановительные реакции, в результате которых получается электрическая энергия, называются
- 30. 12.2.3. Электродвижущая сила гальванического элемента (ЭДС). Электрическая работа, получаемая с помощью гальванического элемента, будет максимальной, когда
- 31. Как уже было показано на примере водородного электрода, электроды, а следовательно, и гальванические элементы могут быть
- 32. Для осуществления таких реакций обычно используют катализатор, который одновременно является проводником электронов, например платину Гальванический элемент
- 33. Значения стандартных электродных потенциалов полуреакций приводятся в справочниках. ЭДС такого элемента при стандартных условиях можно определить
- 34. Таким образом, разность потенциалов на электродах можно не только непосредственно измерить, но и вычислить из чисто
- 35. 12.2.5. Направление окислительно-восстановительных реакций По величинам окислительно-восстановительных потенциалов можно судить о направлении протекания окислительно-восстановительных реакций. Исходя
- 36. При этом учтено, что в таблицах значения ϕ0 приведены для полуреакций в одном направлении − окисления.
- 37. В первом приближении уже путем сравнения стандартных потенциалов полуреакций можно решить вопрос − какая из них
- 38. 12.3. Электролиз. Если электрический ток может вырабатываться за счет химических реакций, то и за счет внешнего
- 39. Рассмотрим, например, электролиз расплава соли CdCl2. При плавлении происходит электролитическая диссоциация соли: CdCl2 → Cd2+ +
- 40. При этом на катоде будет происходить восстановление ионов кадмия, а на аноде − окисление ионов хлора:
- 41. Как видно из величин и знаков этих потенциалов, возникшая ЭДС направлена навстречу внешнему источнику напряжения при
- 42. Имеется несколько причин поляризации электродов: концентрационная поляризация − изменение концентрации ионов у электрода в результате протекания
- 43. Последовательность электродных процессов. В рассмотренном выше примере электролиза расплава CdCl2 в электролите имелись только один вид
- 44. Так как существует поляризация, то определять порядок разрядки ионов на электродах по стандартным значениям потенциалов нельзя,
- 45. Катодные процессы. Катионы металлов, стоящих в ряду напряжений до Аl, и сам Аl не разряжаются на
- 46. Анодные процессы. Анионы также можно расположить в ряд по возрастанию восстановительной активности: F− , NO3− ,
- 47. В концентрированных растворах и расплавах на электродах происходит разрядка сложных анионов и активных катионов с последующими
- 48. Однако анод может быть активным, то есть участвовать в процессе окисления. В этом случае говорят, что
- 49. Реакции электролиза являются такими же химическими реакциями, как и все остальные, т.е. по ним можно производить
- 50. При прохождении одного и того же количества электричества через раствор или расплав электролита массы (объемы) веществ,
- 51. 12.4. Аккумуляторы и топливные элементы Применение электрохимических устройств и процессов весьма многообразно. Прежде всего − это
- 52. В основе его действия лежит электрохимическая цепь: (−) Pb | PbSO4 к ║H2SO4 р║ PbO2 к
- 53. Другой разновидностью химических источников электрической энергии являются топливные элементы. Это устройства, в которых в качестве реагентов
- 54. Подобные топливные элементы получили определенное распространения, разработка их проводится весьма интенсивно. Первоначально, использовались на космических кораблях
- 55. 13. Коррозия металлов. Для большинства металлов в условиях эксплуатации наиболее устойчивым состоянием является окисное (ионное). Коррозией
- 56. Основные механизмы протекания коррозионных процессов − электрохимический и химический. Критерием протекания коррозии по одному из перечисленных
- 57. Окисление металлов в отсутствие влаги можно представить следующими процессами: - на межфазной границе металл-оксид: Me -
- 58. Основные две стадии гетерогенного процесса химической коррозии определяют суммарную скорость коррозии: адсорбция окислителя O2 поверхностью материала
- 59. Взаимодействие поверхностных атомов металла с кислородом приводит к образованию вначале мономолекулярного, а затем более объемного слоя
- 60. Электрохимическая коррозия - наиболее распространенный вид коррозии металлов, это разрушение металла в среде электролита с возникновением
- 61. При электрохимической коррозии на поверхности металла одновременно протекают два процесса: - анодный - окисление металла: Me
- 62. Для количественной оценки коррозии определяют либо коррозионные потери (отношение изменения массы испытуемого образца к площади его
- 63. Глубинный показатель коррозии h (мм/год) представляет собой уменьшение толщины металла (в линейных единицах), отнесенное к единице
- 64. 13.2. Способы защиты от коррозии 1. Профилактика коррозии, т.е. предупреждение протекания коррозионных процессов на стадиях проектирования,
- 65. б) электрохимического анодирования при электролизе. Например, естественная оксидная пленка на алюминии толщиной около 8 мкм может
- 67. Скачать презентацию
































































 Вуглеводи
Вуглеводи Производство серной кислоты
Производство серной кислоты Применение некоторых химических веществ. Задание 1
Применение некоторых химических веществ. Задание 1 Понятие об ароматических спиртах и фенолах. Особенности строения фенола
Понятие об ароматических спиртах и фенолах. Особенности строения фенола Использование катионных красителей в экстракционно-флуориметрическом анализе
Использование катионных красителей в экстракционно-флуориметрическом анализе Ювелирные камни
Ювелирные камни Общая характеристика криптона
Общая характеристика криптона Презентация на тему Алкены. Строение. Изомерия. Химические свойства. Получение
Презентация на тему Алкены. Строение. Изомерия. Химические свойства. Получение  Реакцияға қабілетті олигомерлердің мономерлерге қарағанда артықшылығы
Реакцияға қабілетті олигомерлердің мономерлерге қарағанда артықшылығы Триметилалюминий
Триметилалюминий Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ  атомно-молекулярное учение (1)
атомно-молекулярное учение (1) Основания. Определение. Формулы
Основания. Определение. Формулы Природные кристаллы
Природные кристаллы Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Физическая химия, термодинамика
Физическая химия, термодинамика теория строения
теория строения Агрегатные состояния веществ
Агрегатные состояния веществ Минералы. Внутренняя структура минералов
Минералы. Внутренняя структура минералов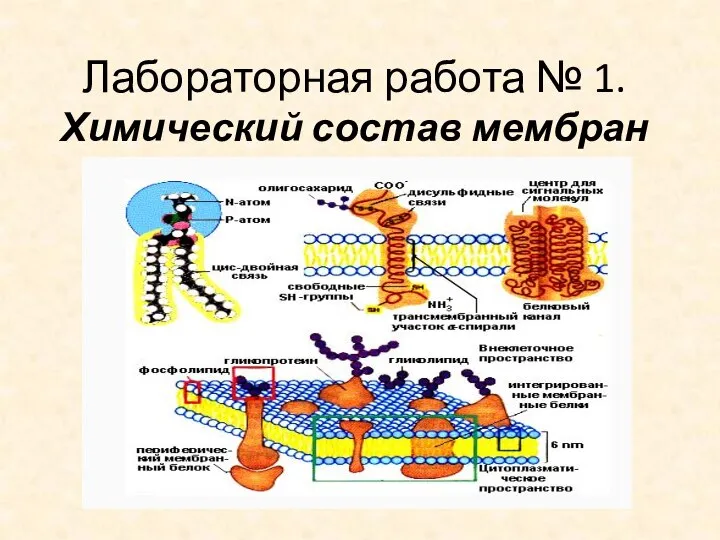 Химический состав мембран. Лабораторная работа № 1
Химический состав мембран. Лабораторная работа № 1 Физико-химические методы анализа. Лекция № 1
Физико-химические методы анализа. Лекция № 1 кремний и его соединения
кремний и его соединения Презентация на тему Теория строения химических соединений А.М.Бутлерова
Презентация на тему Теория строения химических соединений А.М.Бутлерова  ЛК 2_окислительно-восстановительные процессы
ЛК 2_окислительно-восстановительные процессы Интерактивный плакат Алканы
Интерактивный плакат Алканы Алканы. Строение и изомерия
Алканы. Строение и изомерия Основания. Классификация
Основания. Классификация Степень окисления
Степень окисления