Содержание
- 2. Азот принадлежит к числу достаточно распространенных химических элементов Содержание азота в различных сферах Земли колеблется в
- 3. Методы связывания атмосферного азота В начале XX века почти одновременно были разработаны три технических метода синтеза
- 4. Дуговой метод В основе дугового метода лежит эндотермическая реакция прямого окисления азота кислородом воздуха, протекающая при
- 5. Цианамидный метод Цианамидный метод основан на способности тонкоизмельченного карбида кальция реагировать при температуре около 1000°С с
- 6. Аммиачный метод В основе аммиачного метода лежит реакция взаимодействия азота и водорода: N2 + 3Н2 ↔
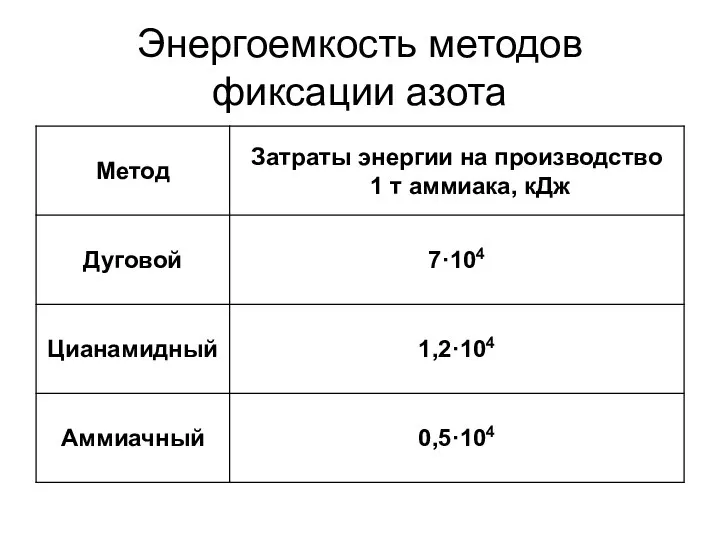
- 7. Энергоемкость методов фиксации азота
- 8. В последнее время дуговой метод, не получивший промышленного применения вследствие низкого (менее 0,02 дол. ед.) выхода
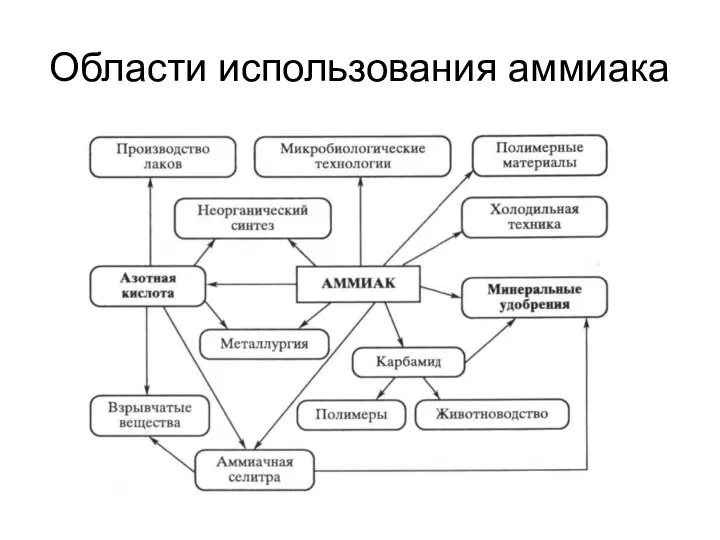
- 9. Области использования аммиака
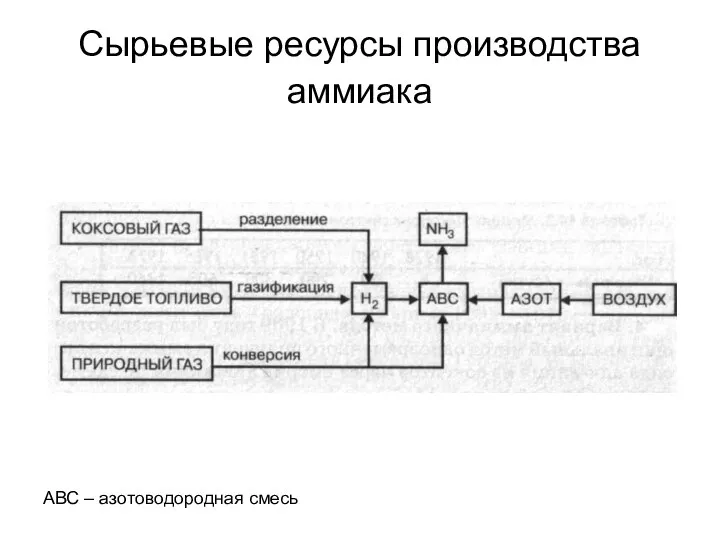
- 10. Сырье для производства аммиака Азот – атмосфера Водород – природный газ, кокс, твердое топливо Структура сырьевой
- 11. Сырьевые ресурсы производства аммиака АВС – азотоводородная смесь
- 12. Основная стадия процесса синтеза аммиака из азотоводородной смеси описывается уравнением: N2 + 3Н2 = 2NH3. Реакции
- 13. N2 + 3Н2 = 2NH3, тепловой эффект реакции зависит от температуры и давления и составляет 111,6
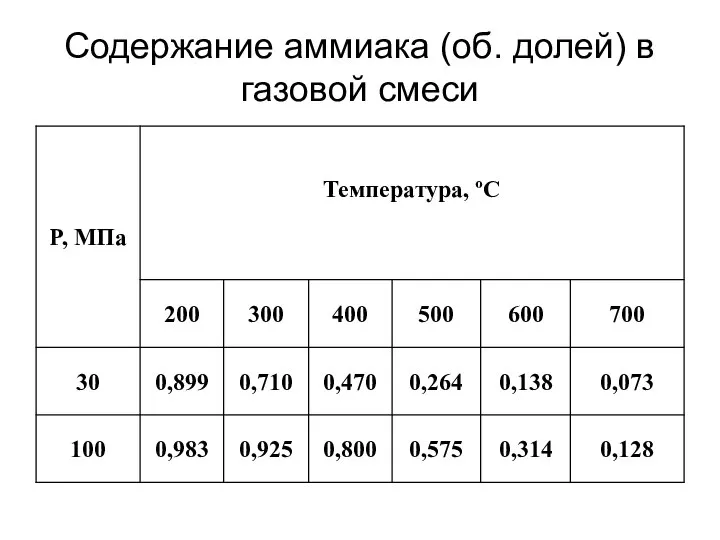
- 14. Содержание аммиака (об. долей) в газовой смеси
- 15. Катализатор для синтеза аммиака Реакция синтеза аммиака катализируется металлами, имеющими не полностью застроенные d - и
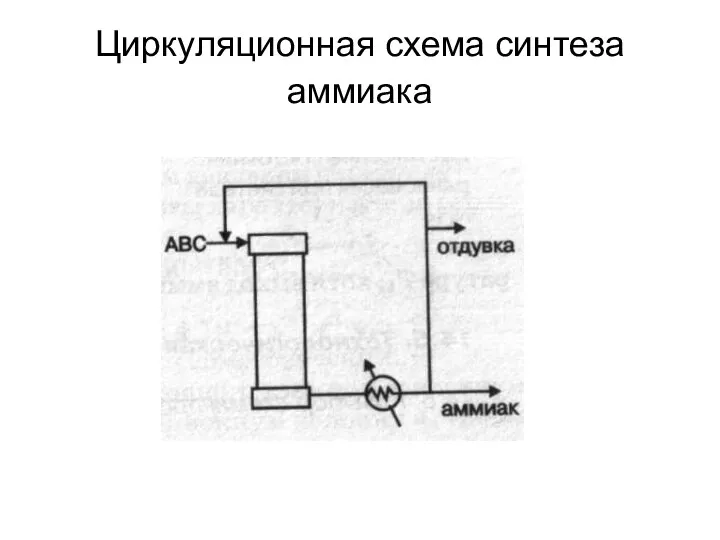
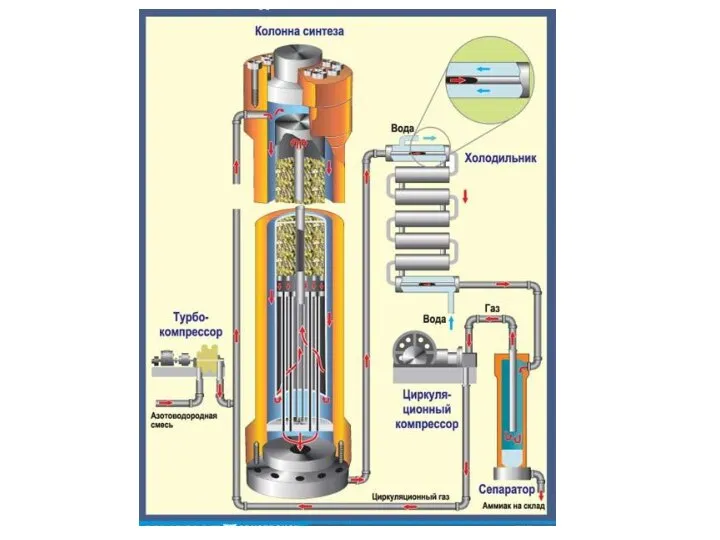
- 16. Циркуляционная схема синтеза аммиака
- 17. Для выделения образовавшегося аммиака АВС охлаждают до температуры сжижения аммиака. При этом часть аммиака остается в
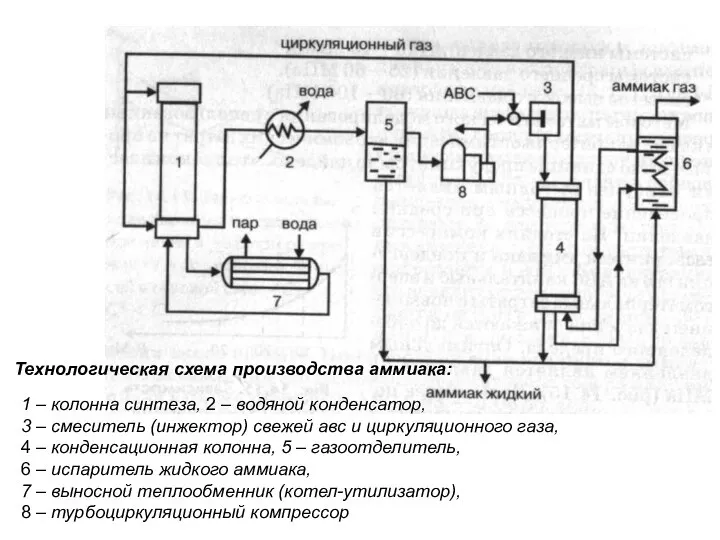
- 18. 1 – колонна синтеза, 2 – водяной конденсатор, 3 – смеситель (инжектор) свежей авс и циркуляционного
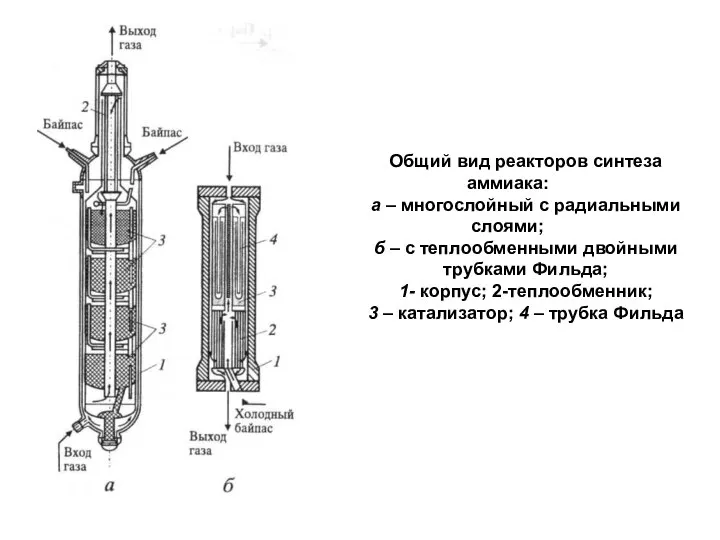
- 19. Общий вид реакторов синтеза аммиака: а – многослойный с радиальными слоями; б – с теплообменными двойными
- 22. Скачать презентацию











 Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Определение плотности газообразного вещества по плотности
Определение плотности газообразного вещества по плотности Воздух
Воздух Презентация на тему Керамика
Презентация на тему Керамика  Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Основы трибологии и триботехники. Смазка и смазочные материалы
Основы трибологии и триботехники. Смазка и смазочные материалы Синтетические материалы
Синтетические материалы Самостоятельная работа
Самостоятельная работа Химические реакции
Химические реакции Основы переработки нефти и нефтепродуктов
Основы переработки нефти и нефтепродуктов Презентация на тему Соли аммония
Презентация на тему Соли аммония  Кислород
Кислород Полимеры
Полимеры Хром (Cr)
Хром (Cr) Простые вещества - металлы
Простые вещества - металлы Магний
Магний Металлическая, водородная, Ван-дер-ваальсова химические связи
Металлическая, водородная, Ван-дер-ваальсова химические связи Подготовка проб товаров к анализу. Химико-аналитический контроль
Подготовка проб товаров к анализу. Химико-аналитический контроль Ртуть. Правила работы со ртутью
Ртуть. Правила работы со ртутью Vvedenie_v_khimiyu
Vvedenie_v_khimiyu Триметилалюминий
Триметилалюминий Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Периодический закон и Периодическая система химических элементов Д. И. Менделеева
Периодический закон и Периодическая система химических элементов Д. И. Менделеева Использование культурологического компонента на уроках химии
Использование культурологического компонента на уроках химии Презентация на тему Кристаллы
Презентация на тему Кристаллы  Металлы. Атомы металлов
Металлы. Атомы металлов Минерал дунит
Минерал дунит