Содержание
- 2. Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами
- 3. Гомологический ряд алкинов Все алкины имеют общие или похожие физические и химические свойства. Схожие по строению
- 4. Первые три члена гомологического ряда алкинов – газы, начиная с C5Н8 по С16Н30 – жидкости, начиная
- 5. Строение алкинов В молекуле ацетилена присутствуют химические связи C–H и С≡С. Связь C–H ковалентная слабополярная одинарная
- 6. Поэтому две гибридные орбитали атомов углерода при тройной связи в алкинах направлены в пространстве под углом
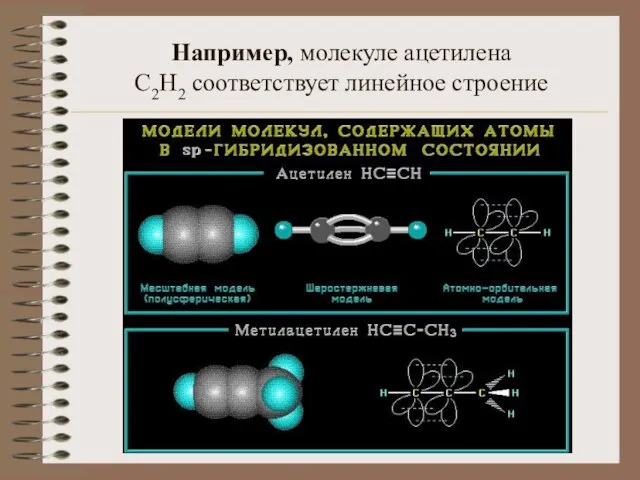
- 7. Например, молекуле ацетилена C2H2 соответствует линейное строение
- 8. Изомерия алкинов Для алкинов характерна структурная и пространственная изомерия. Структурная изомерия Для алкинов характерна изомерия углеродного
- 9. Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкины являются межклассовыми
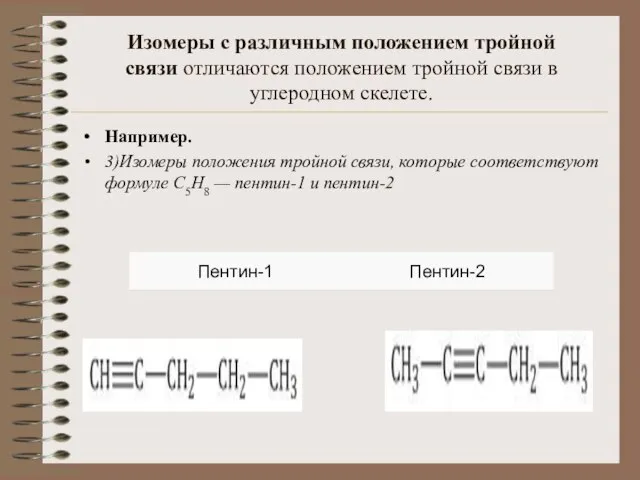
- 10. Изомеры с различным положением тройной связи отличаются положением тройной связи в углеродном скелете. Например. 3)Изомеры положения
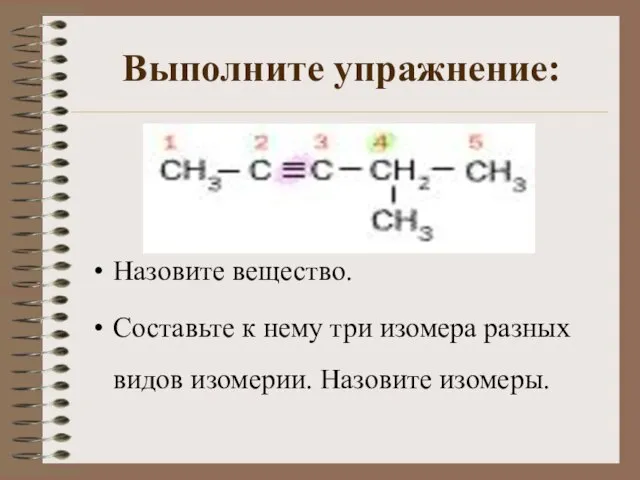
- 11. Выполните упражнение: Назовите вещество. Составьте к нему три изомера разных видов изомерии. Назовите изомеры.
- 12. Пространственная изомерия Для некоторых алкинов также характерна оптическая изомерия. Алкины, которые обладают достаточно большим углеродным скелетом,
- 13. Химические свойства 1. Реакции присоединения (характерны реакции присоединения по тройной связи С≡С с разрывом π-связей.) 2.
- 14. 1.1. Гидрирование протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов. Например,
- 15. 1.2. Галогенирование Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода,
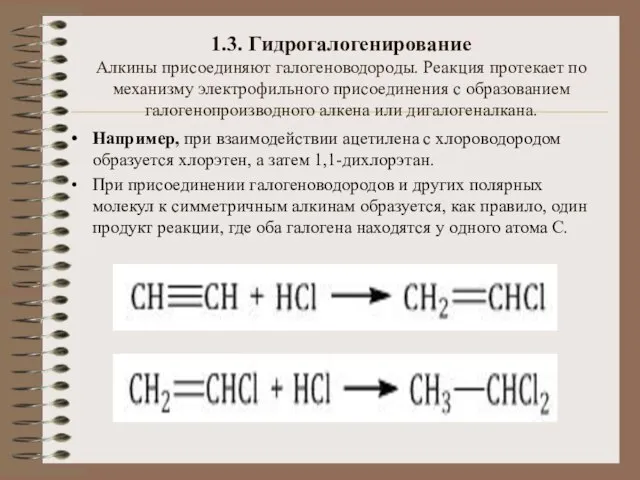
- 16. 1.3. Гидрогалогенирование Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или
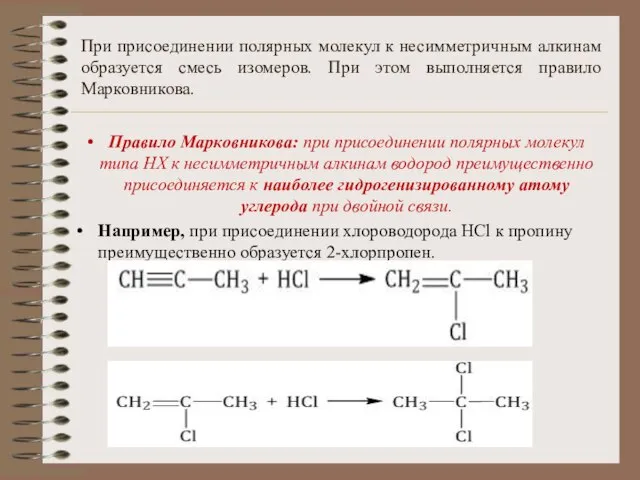
- 17. При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова. Правило
- 18. 1.4. Гидратация (присоединение воды протекает в присутствии кислоты и катализатора (соли ртути II). Сначала образуется неустойчивый
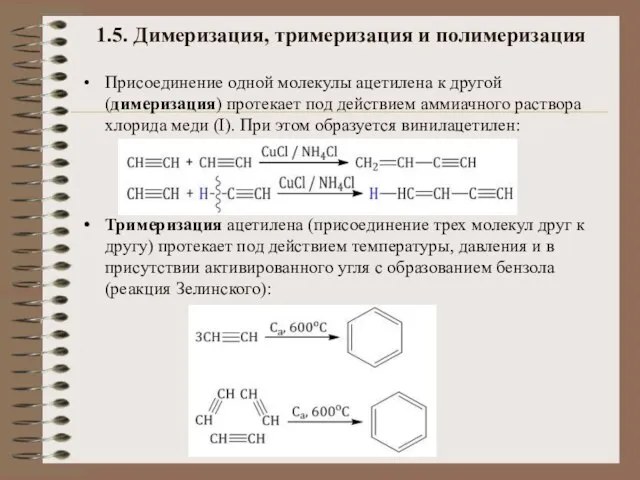
- 19. 1.5. Димеризация, тримеризация и полимеризация Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного
- 20. Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с
- 21. 2. Окисление 2.1. Горение Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
- 22. 2.2. Окисление сильными окислителями Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом
- 23. А)при окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C≡, поэтому образуется
- 24. В)при окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ)
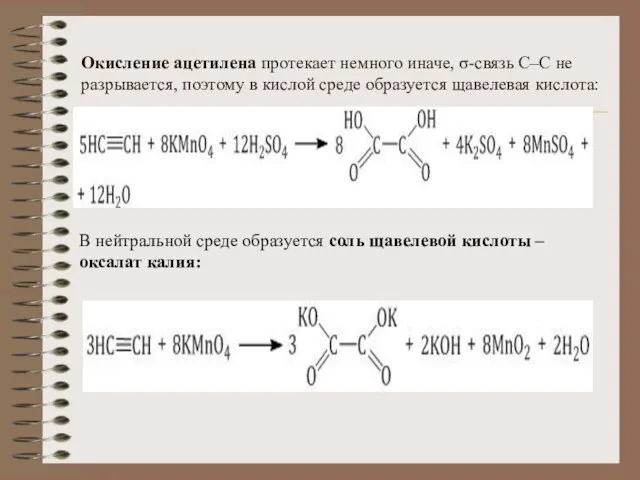
- 25. Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
- 26. 3. Кислотные свойства Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом
- 27. Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления
- 28. Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным
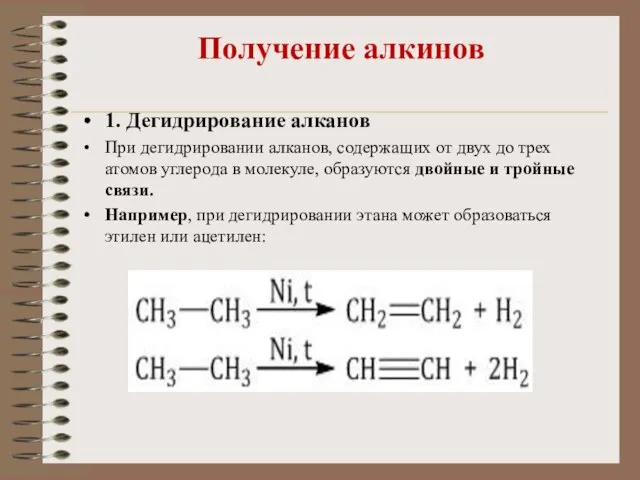
- 29. Получение алкинов 1. Дегидрирование алканов При дегидрировании алканов, содержащих от двух до трех атомов углерода в
- 30. 2. Пиролиз метана Пиролиз метана – это промышленный способ получения ацетилена. Реакцию проводят, очень быстро пропуская
- 31. 3. Гидролиз карбида кальция Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2.
- 32. 4. Дегидрогалогенирование дигалогеналканов Дигалогеналканы, в молекулах которых два атома галогена расположены у одного, либо у соседних
- 33. 5. Алкилирование соединений алкинов с металлами Ацетилениды, пропиниды и прочие соединения алкинов с металлами реагируют с
- 35. Скачать презентацию
























 Спирты, карбоновые кислоты
Спирты, карбоновые кислоты Анализ стабильности экологических характеристик товарных дизельных топлив после перекачки
Анализ стабильности экологических характеристик товарных дизельных топлив после перекачки Пероксид водорода
Пероксид водорода Классы неорганических веществ
Классы неорганических веществ Модель Андерсона
Модель Андерсона Определение волокнистого состава хлопчатобумажных тканей. Практическая работа
Определение волокнистого состава хлопчатобумажных тканей. Практическая работа Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков gidroliz_soley (1)
gidroliz_soley (1) Неметаллы. Общие свойства
Неметаллы. Общие свойства Соли. Свойства. Получение
Соли. Свойства. Получение Типичные реакции основных и кислотных оксидов
Типичные реакции основных и кислотных оксидов 8-29 класс (1)
8-29 класс (1) Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Презентация на тему Интеллект – мой выбор
Презентация на тему Интеллект – мой выбор  Триметилалюминий
Триметилалюминий Физические свойства металлов
Физические свойства металлов Кислоты. Общая формула кислот
Кислоты. Общая формула кислот Метанол. Краткая характеристика
Метанол. Краткая характеристика Вебинар. Гидролиз солей
Вебинар. Гидролиз солей Вывод формул химических веществ
Вывод формул химических веществ Определение площади поверхности и пористости материалов методом сорбции газов
Определение площади поверхности и пористости материалов методом сорбции газов Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Основные соединения кальция и их применение – вчера, сегодня, завтра.
Основные соединения кальция и их применение – вчера, сегодня, завтра. Нуклеиновые кислоты
Нуклеиновые кислоты Полисахариды
Полисахариды Формула аспирина. Решение задач
Формула аспирина. Решение задач Презентация на тему Углекислый газ
Презентация на тему Углекислый газ