Содержание
- 2. Основной вопрос: «Что такое химия?» Тезис: химия – наука о превращениях вообще. Это так? Давайте превратим
- 3. Основная задача химии – изучить возможности и закономерности таких превращений веществ, которые сопровождаются перераспределением электронной плотности
- 4. Система – совокупность тел, находящихся во взаимодействии между собой и отделенных от окружающей среды. Компонентом или
- 5. Вернемся к основному стехиометрическому закону. Возникает сложность в том, как действует этот закон для твердой фазы
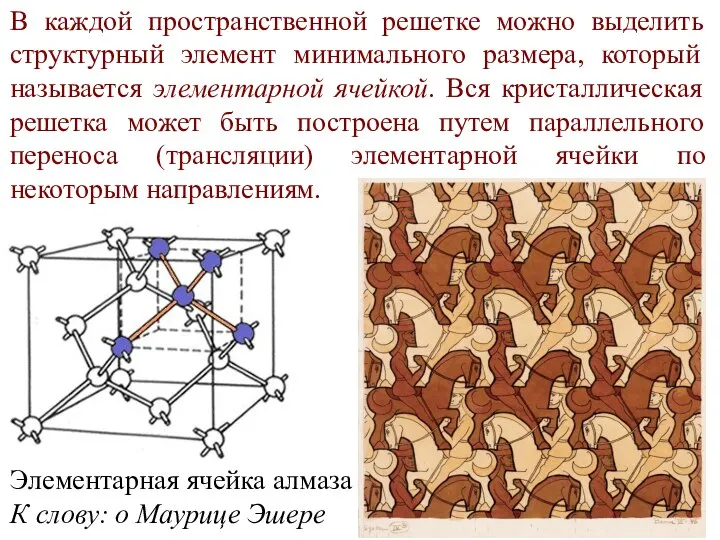
- 6. В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая
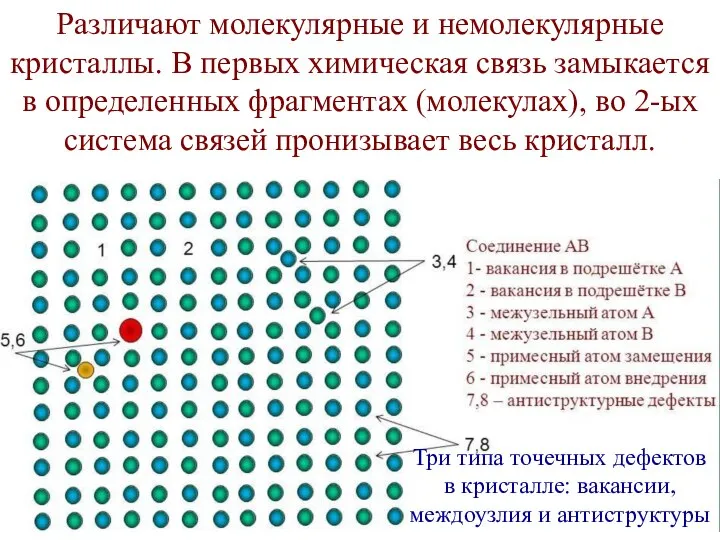
- 9. Различают молекулярные и немолекулярные кристаллы. В первых химическая связь замыкается в определенных фрагментах (молекулах), во 2-ых
- 10. Пример окрашенного сильвина (KCl). Содержит избыток калия за счет образования вакансий в подрешетке хлора Можно получить,
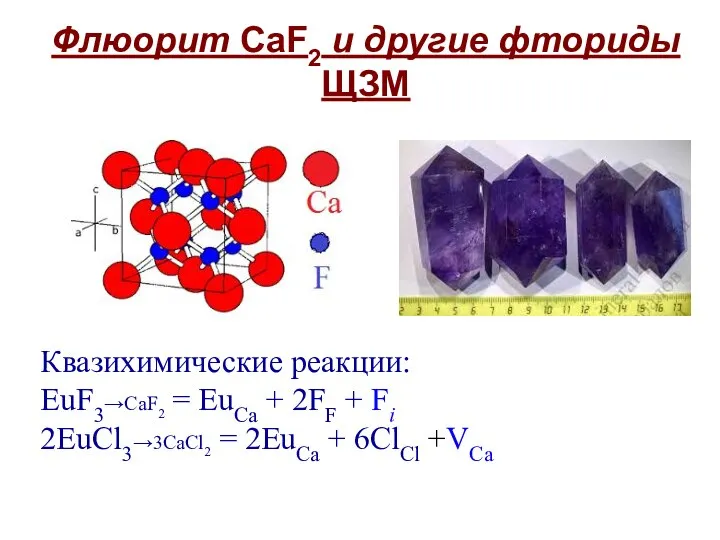
- 11. Флюорит CaF2 и другие фториды ЩЗМ Квазихимические реакции: EuF3→CaF2 = EuCa + 2FF + Fi 2EuCl3→3CaCl2
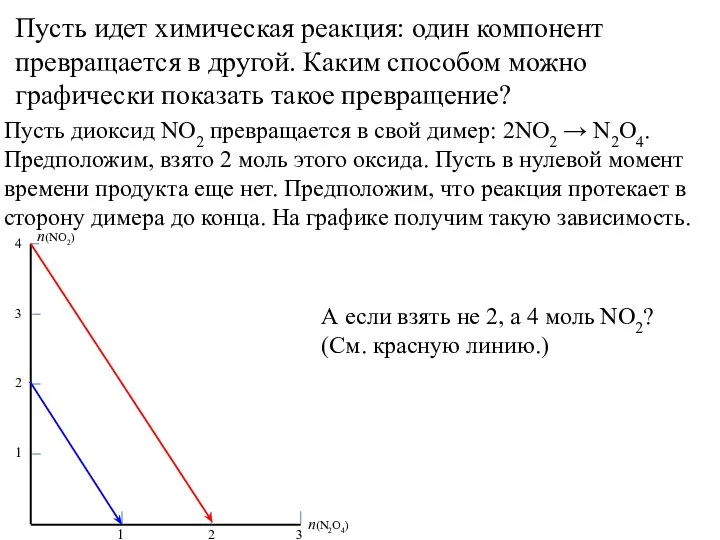
- 12. Пусть идет химическая реакция: один компонент превращается в другой. Каким способом можно графически показать такое превращение?
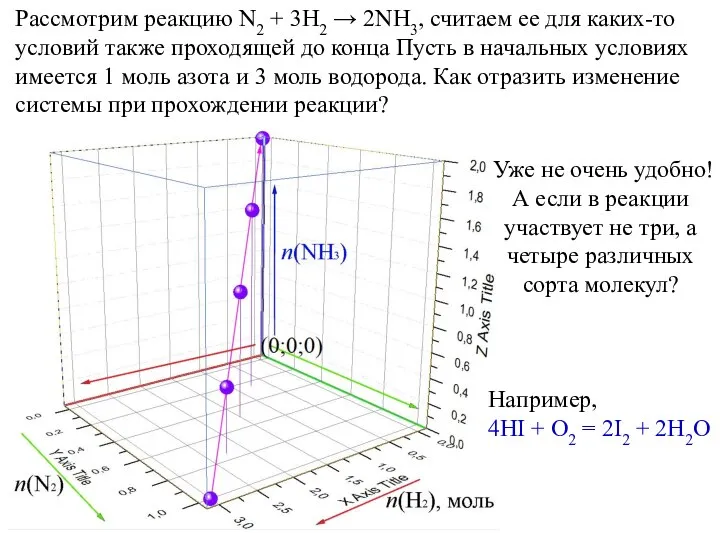
- 13. Рассмотрим реакцию N2 + 3H2 → 2NH3, считаем ее для каких-то условий также проходящей до конца
- 14. Выход есть. Полезно введение химической переменной ξ Подметим, что для рассматриваемой реакции 4HI + O2 =
- 15. Учение о химических процессах. Две части: Химическая термодинамика; Химическая кинетика. Химическая термодинамика – раздел химии о
- 16. Три основные части химической кинетики. Феноменологическая кинетика – описание зависимости скорости реакции веществ от концентраций, температуры
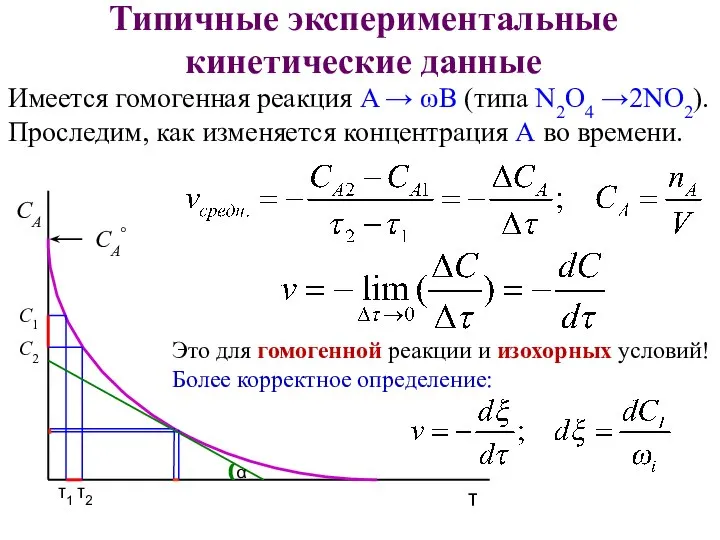
- 17. Типичные экспериментальные кинетические данные Имеется гомогенная реакция A → ωB (типа N2O4 →2NO2). Проследим, как изменяется
- 19. Скачать презентацию










 Презентация на тему Полимеразная цепная реакция
Презентация на тему Полимеразная цепная реакция  Понятие о химической реакции. Реакции, идущие без изменения состава веществ. 11 класс
Понятие о химической реакции. Реакции, идущие без изменения состава веществ. 11 класс Презентация на тему Химическая связь (8 класс)
Презентация на тему Химическая связь (8 класс)  Классы неорганических веществ
Классы неорганических веществ Металлы. 9 класс
Металлы. 9 класс Примеры реакций в жизни и в быту. Реакции по направлению процесса
Примеры реакций в жизни и в быту. Реакции по направлению процесса Виды химической связи
Виды химической связи Общие способы получения металлов
Общие способы получения металлов Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп Классификация реакций
Классификация реакций Электролитическая диссоциация
Электролитическая диссоциация Структура неорганических ионных соединений. Лекция 12
Структура неорганических ионных соединений. Лекция 12 Материаловедение. Стали. Свойства сталей. Классификация сталей
Материаловедение. Стали. Свойства сталей. Классификация сталей Основы химической термодинамики
Основы химической термодинамики Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков Алкадиены
Алкадиены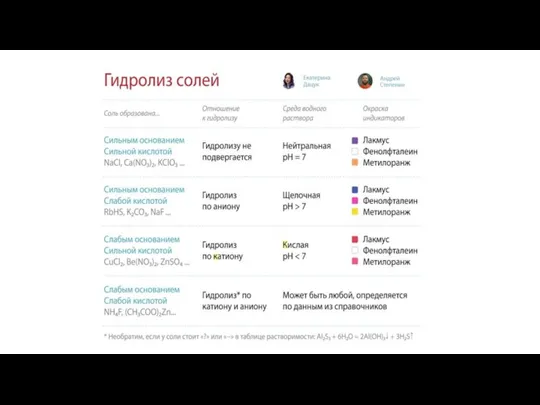 Гидролиз солей
Гидролиз солей Химическое равновесие. Экзаменационные вопросы
Химическое равновесие. Экзаменационные вопросы Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе  Рука руку моет. Механизм двух реакций
Рука руку моет. Механизм двух реакций Презентация на тему Пестициды
Презентация на тему Пестициды  Свойства радиоактивных элементов
Свойства радиоактивных элементов Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Соли Na2SO4
Соли Na2SO4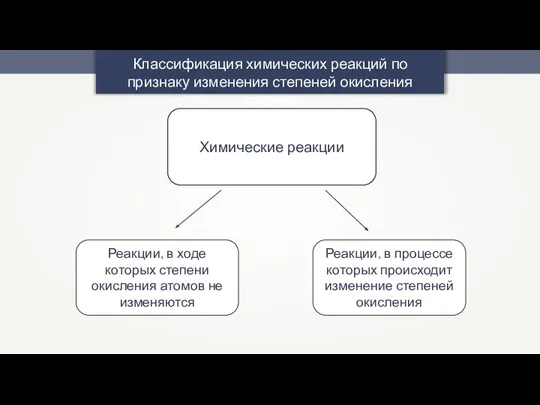 Окислительно-восстановительные реакции. Электролиз
Окислительно-восстановительные реакции. Электролиз Углеводороды. Характеристика
Углеводороды. Характеристика