Содержание
- 2. Окислительно –восстановительные реакции ОВР 9класс
- 3. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) – реакции, протекающие с изменением степени окисления. ОВР – реакции, в результате которых
- 4. Два антипода парою ходят, Первый – теряет; второй - находит, Ролью меняясь при этом порой… Кто
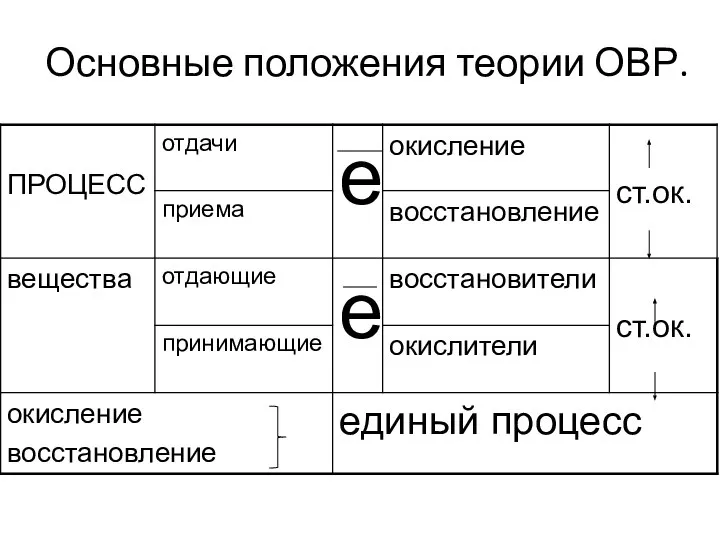
- 5. Основные положения теории ОВР.
- 6. Алгоритм составления ОВР Определить степени окисления элементов в соединениях, участвующих в реакции. Выявить элемент, степень окисления
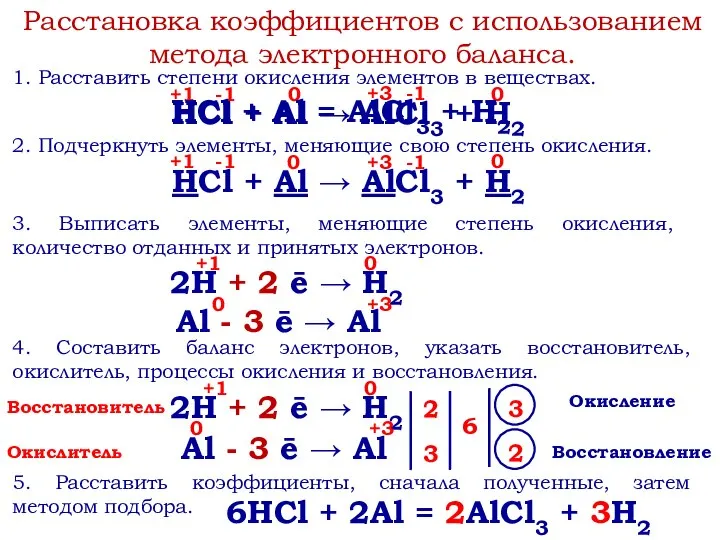
- 7. Расстановка коэффициентов с использованием метода электронного баланса. 1. Расставить степени окисления элементов в веществах. 2. Подчеркнуть
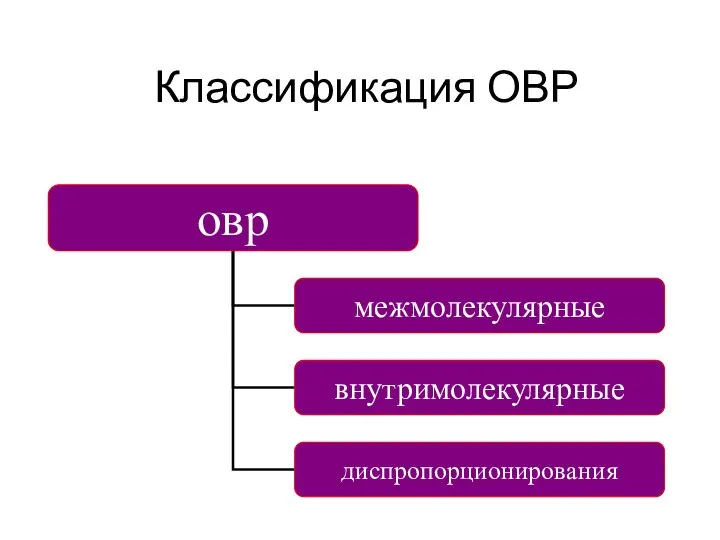
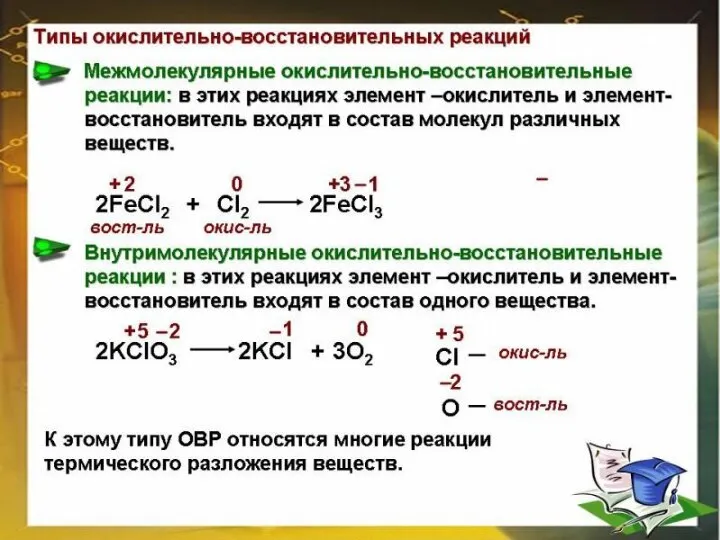
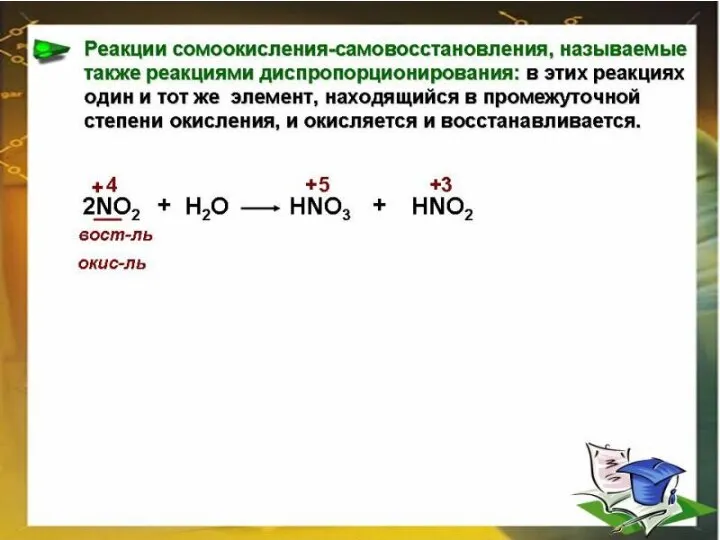
- 8. Классификация ОВР
- 11. Используя метод электронного баланса, преобразуйте схемы в уравнения реакций: а) V2O5 + Al → Al2O3 +
- 12. Т Е С Т Укажите ОВР: а) PH₃ + 2O₂ = H₃PO₄ б) KOH + HCl
- 14. Скачать презентацию






 Электролитическая диссоциация
Электролитическая диссоциация Классификация неорганических веществ
Классификация неорганических веществ Химический алфавит. Алфавит
Химический алфавит. Алфавит Скорость химической реакции
Скорость химической реакции Основания, их состав и название
Основания, их состав и название Периодическая система элементов, строение атома
Периодическая система элементов, строение атома строение атома углерода. Валентные состояния атома углерода
строение атома углерода. Валентные состояния атома углерода Нефть по ГОСТ Р 51858-2002
Нефть по ГОСТ Р 51858-2002 Предельные углеводороды. Тест 19
Предельные углеводороды. Тест 19 Метод проекта на уроках химии и биологии и внеурочное время
Метод проекта на уроках химии и биологии и внеурочное время Презентация на тему Славный путь М.В. Ломоносова
Презентация на тему Славный путь М.В. Ломоносова  Мутагены окружающей среды
Мутагены окружающей среды Строение сплавов, диаграммы состояний
Строение сплавов, диаграммы состояний Природные кислоты и щелочи. Индикаторы
Природные кислоты и щелочи. Индикаторы Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Презентация на тему Водородная связь (11 класс)
Презентация на тему Водородная связь (11 класс)  Классификация органических соединений
Классификация органических соединений ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски Простые вещества - металлы
Простые вещества - металлы Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Белки-1 2020
Белки-1 2020 Скорость химических реакций
Скорость химических реакций Rozcieńczanie i zatężanie roztworów
Rozcieńczanie i zatężanie roztworów Стереоизомерия
Стереоизомерия Химическая картина мира
Химическая картина мира Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Строение веществ
Строение веществ 14257fc50bc406ef33f49ad14aa3f48b
14257fc50bc406ef33f49ad14aa3f48b