Содержание
- 2. Закономерности изменения и распространения изотопов В геологической науке большое значение имеет восстановление картины прошлой жизни горных
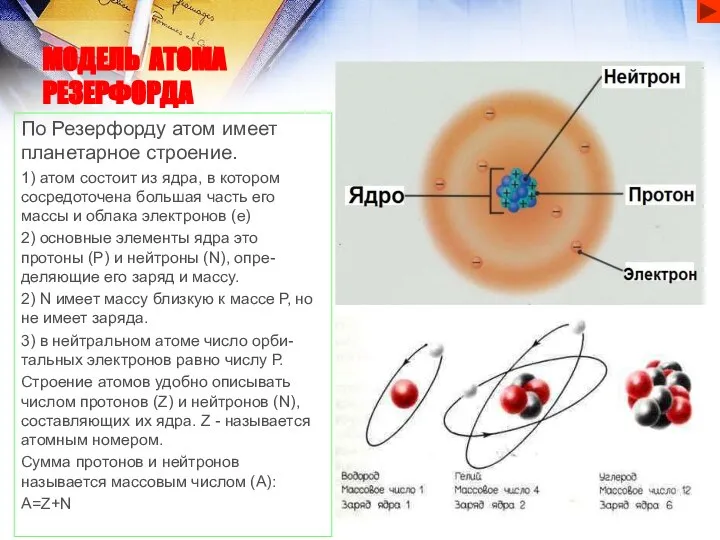
- 3. МОДЕЛЬ АТОМА РЕЗЕРФОРДА По Резерфорду атом имеет планетарное строение. 1) атом состоит из ядра, в котором
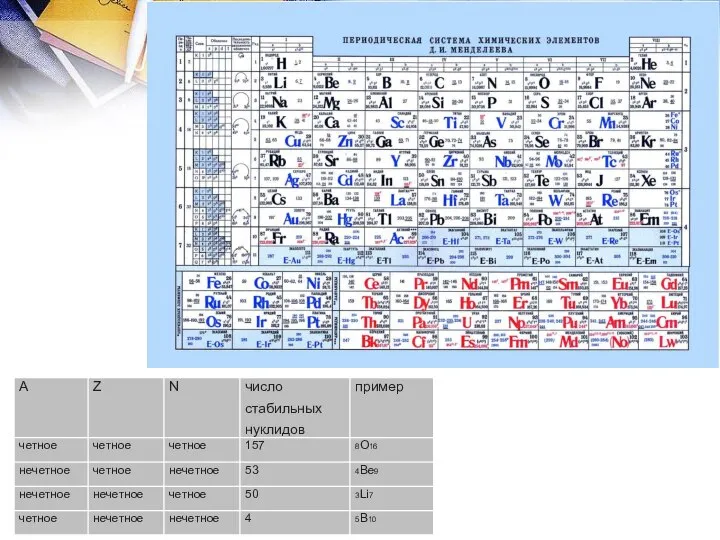
- 4. В зависимости от числа нейтронов и протонов химических элементов выделяются:
- 5. Диаграмма нуклидов На диаграмме нуклидов стабильные изотопы, представленные затемненными квадратами, образуют полосу, окруженную нестабильными нуклидами.
- 7. РАДИОАКТИВНОСТЬ И ЕЕ ВИДЫ, ЗАКОН РАДИОАКТИВНОГО РАСПАДА, УРАВНЕНИЕ ОПРЕДЕЛЕНИЯ ВОЗРАСТА Радиоактивностью называется самопроизвольные превращения ядер неустойчивых
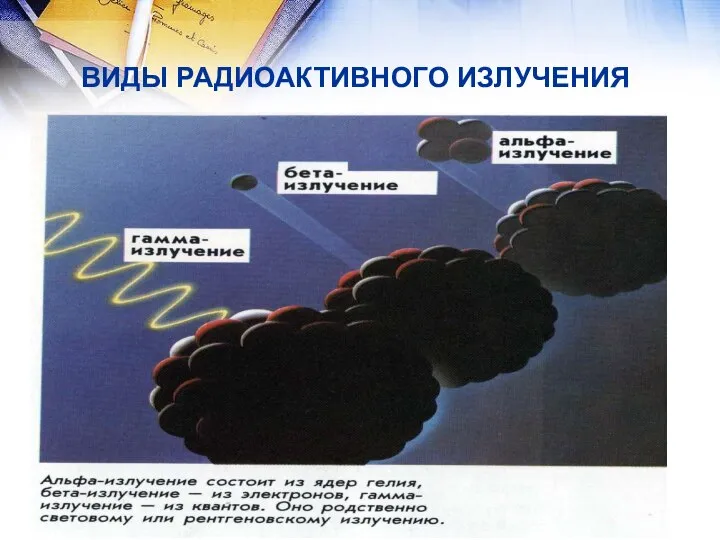
- 8. ВИДЫ РАДИОАКТИВНОГО ИЗЛУЧЕНИЯ
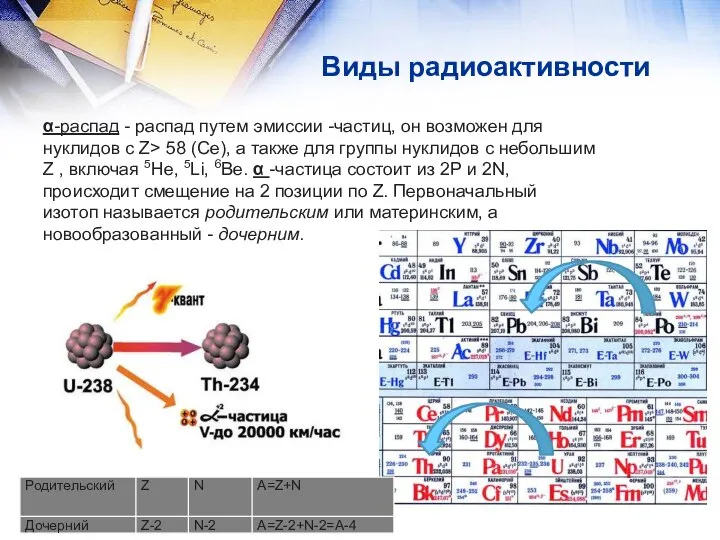
- 9. Виды радиоактивности α-распад - распад путем эмиссии -частиц, он возможен для нуклидов с Z> 58 (Се),
- 10. β-распад - имеет три вида : обычный β -распад, позитронный β -распад и электронный захват. Обычный
- 11. + Положительная частица + Позитронный β -распад - эмиссия из ядра положительной частицы позитрона β +
- 12. Электро́нный захва́т, e-захват. При электронном захвате один из протонов ядра захватывает орбитальный электрон и превращается в
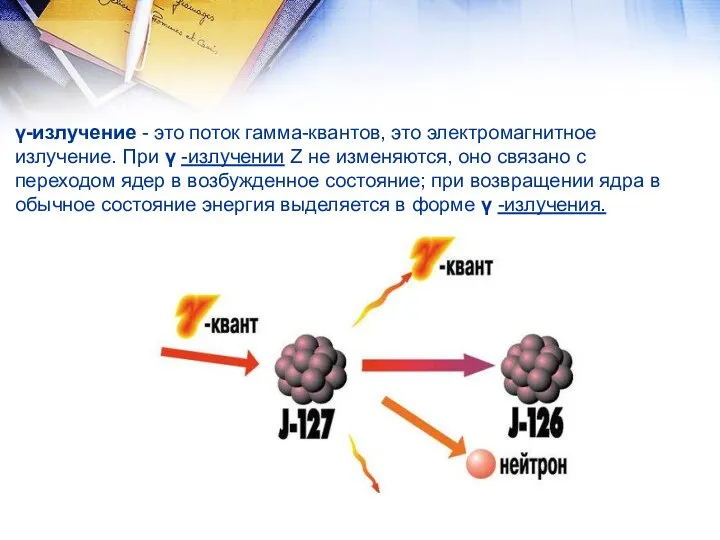
- 13. γ-излучение - это поток гамма-квантов, это электромагнитное излучение. При γ -излучении Z не изменяются, оно связано
- 14. Геохимия некоторых изотопов и их использование в геологии Геохронология – определение «абсолютного возраста минералов и пород.
- 15. Закон радиоактивного распада
- 16. Основное уравнение, описывающее все виды радиоактивного распада. Пронтегрировав от t=0 до t, и считая что в
- 17. Уравнение числа атомов дочернего изотопа в любой момент t, которое образовалось из начального числа атомов родительского
- 18. Период полураспада – основная величина, определяющая скорость радиоактивного распада. 10 -6
- 19. Геохронологическая шкала Геохронологическая шкала - это шкала естественноисторического развития главным образом земной коры, выраженная в числовых
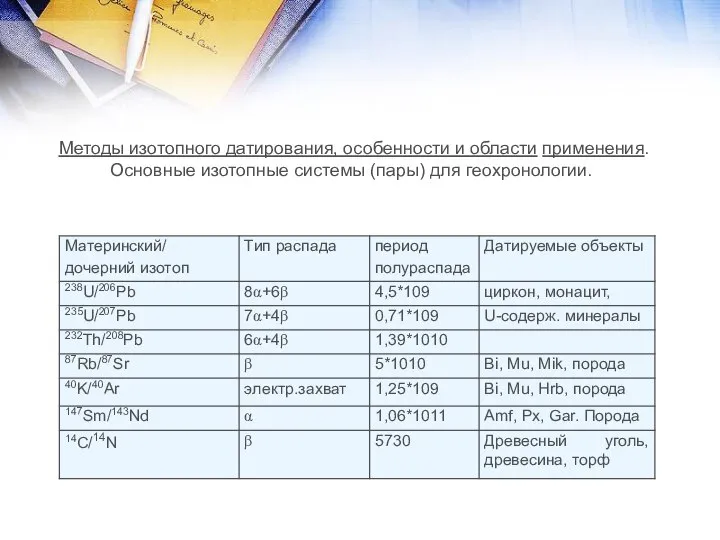
- 20. Методы изотопного датирования, особенности и области применения. Основные изотопные системы (пары) для геохронологии.
- 21. Rb-Sr метод определения возраста Rb - щелочной Ме группы IА (также как и К), его ионный
- 22. Sm-Nd метод определения возраста Nd и Sm - это РЗЭ, образуют ионы с зарядом +3, Nd
- 23. U-Pb и Th-Pb методы определения возраста Распад U и Th с образованием стабильных изотопов Pb является
- 24. Pb имеет 4 изотопа 208Pb, 207 Pb,206Pb и 204Pb. Последний является нерадиогенным и используется в качестве
- 25. Геохимия стабильных изотопов Главной задачей изучения геохимии изотопов является установление условий их фракционирования, изменения их отношений
- 26. Изотопы водорода 1H – протий (99,98%); 2Н(D) – дейтерий (0,015%); 3Н(T) - тритий (T/H=10-18). Значительное различие
- 27. Изотопы кислорода 16О (99,76%); 17О (0,037%); 18О(0,203%). В воде больше 16О, а в атмосфере - 18О;
- 28. Природная вода состоит из 3-х стабильных изотопов кислорода и 2-х стабильных изотопов водорода, что определяет существование
- 29. Изотопы углерода 12С (98,90%); 13С (1,10%); 14С(следы, радиактивен; Т1/2=5730 лет 14С образуется при взаимодействии атмосферного N
- 31. Скачать презентацию






















 Свойство металлов и сплавов
Свойство металлов и сплавов Энергосбережение в нашей жизни
Энергосбережение в нашей жизни Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11 Маска откройся
Маска откройся Природный газ
Природный газ Дисперсные системы и поверхностные явления
Дисперсные системы и поверхностные явления Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Сера, значение и применение
Сера, значение и применение Основные обозначения. Основные понятия. Практическая работа № 2
Основные обозначения. Основные понятия. Практическая работа № 2 Зависимость знака заряда белка от pH
Зависимость знака заряда белка от pH Строение атома
Строение атома Основи масообміну
Основи масообміну Кислоты. Классификация кислот
Кислоты. Классификация кислот Алкены
Алкены Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Презентация на тему Вопросы от …
Презентация на тему Вопросы от …  Атом. Изотопы
Атом. Изотопы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Ca КАЛЬЦИЙ
Ca КАЛЬЦИЙ Презентация на тему Полисахариды
Презентация на тему Полисахариды  Алкадиены. Физические свойства
Алкадиены. Физические свойства Химия – это наука о …
Химия – это наука о … Портландцемент гидравликалық байланыстырғыш
Портландцемент гидравликалық байланыстырғыш Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу химия конеч 3.0
химия конеч 3.0 Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Метод МО Хюккеля (МОХ)
Метод МО Хюккеля (МОХ)