Слайд 2Цель и задачи
Определить количество этилендиамина, содержащееся в образцах соединения [Gd(en)x][Fe(CN)6]
Отработка методики индикаторного
![Цель и задачи Определить количество этилендиамина, содержащееся в образцах соединения [Gd(en)x][Fe(CN)6] Отработка](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/877850/slide-1.jpg)
кислотно-основного титрования
Подготовка рабочих растворов
Титрование образов [Gd(en)x][Fe(CN)6] и обсчет плученных данных
Слайд 3Комплексные соли
Комплексные соли – продукты сочетания солей металлов с почти недиссоциированным на

составные части органическими и неорганическими молекулами, содержащие гетеро-атомы с донорной функцией. Комплексные соли при диссоциации образуют сложные комплексные ионы, которые довольно устойчивы в водных растворах. Ион-комплексообразователь и лиганды составляют внутреннюю сферу, комплексный ион, который может являться как анионом, так и катионом.
Примеры: ??2 [??(OH)4]; ?4 [??(CN)6]; [Ag(NH3)2]Cl; [Ag(H2O)6]Cl3
Двойные комплексные соли – комплексные соли содержащие в себе и комплексный катион, и комплексный анион.
Слайд 4Аммиак и амины.
Неподеленная электронная пара аммиака позволяет во многих реакциях выступать в

качестве основания или комплексообразователя.
Амины - органические соединения, которые можно рассматривать как производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы, которые могут быть разнотипные и одинаковые.
Так как амины являются производными аммиака, то они проявляют подобные ему основные свойства, за счет неподеленной электронной пары азота.
Слайд 5Этилендиамин.
Жидкость без цвета с запахом аммиака, дымит на воздухе, хорошо растворяется в

воде с разогреванием раствора.
Этилендиамин является сильным основанием, так как является алифатическим амином.
Содержит две аминогруппы, является бидентантным лигандом.
Слайд 6Кислот-основное титрование.
Основной является реакция нейтрализации между кислотой и основанием с образованием воды.

Титрование раствором щелочи называется алкалиметрией. Титрование раствором кислоты — ацидиметрией.
Алкалиметрия используется для количественного определения кислот, ацидиметрия – щелочей.
Индикаторное титрование – метод, при котором точка эквивалентности определяется количеством титранта. Точка эквивалентности определяется по смене окраски индикатора.
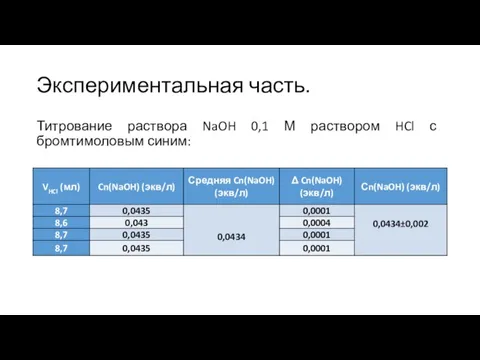
Слайд 7Экспериментальная часть.
Титрование раствора NaOH 0,1 М раствором HCl с бромтимоловым синим:
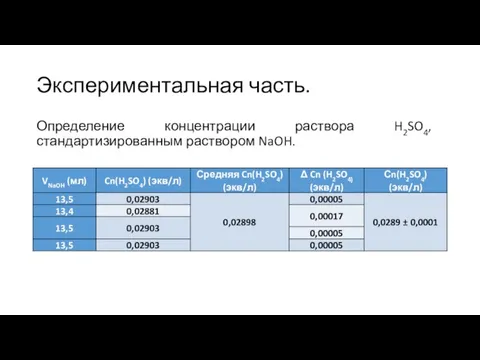
Слайд 8Экспериментальная часть.
Определение концентрации раствора H2SO4, стандартизированным раствором NaOH.
Слайд 9Экспериментальная часть.
Титрование образцов серной кислотой
На массу образца [Gd(en)x][Fe(CN)6] массой 87,5 мг для
![Экспериментальная часть. Титрование образцов серной кислотой На массу образца [Gd(en)x][Fe(CN)6] массой 87,5](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/877850/slide-8.jpg)
оттитровки потребовалось 20 мл раствора серной кислоты.
На массу образца 78,5 мг потребовалось 19 мл серной кислоты.
Сделайте здесь таблицу (масса образца-объем кислоты-количество этилендиамина)
![Цель и задачи Определить количество этилендиамина, содержащееся в образцах соединения [Gd(en)x][Fe(CN)6] Отработка](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/877850/slide-1.jpg)






![Экспериментальная часть. Титрование образцов серной кислотой На массу образца [Gd(en)x][Fe(CN)6] массой 87,5](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/877850/slide-8.jpg)

 Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека  Аммиак. Состав. Строение. Химическая ковалентная полярная связь. Кристаллическая молекулярная решетка
Аммиак. Состав. Строение. Химическая ковалентная полярная связь. Кристаллическая молекулярная решетка Виды автомобильного топлива
Виды автомобильного топлива Бор и его соединения
Бор и его соединения Неметаллы. Особенности электронного строения атомов НМ
Неметаллы. Особенности электронного строения атомов НМ Ртуть. Правила работы со ртутью
Ртуть. Правила работы со ртутью Фенолы
Фенолы Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Физические свойства водорода
Физические свойства водорода Спирты или алканолы
Спирты или алканолы Агрегатное состояние вещества
Агрегатное состояние вещества Полезные ископаемые
Полезные ископаемые Презентация на тему Чистые вещества и смеси. Химический диктант
Презентация на тему Чистые вещества и смеси. Химический диктант  Основы химической термодинамики
Основы химической термодинамики Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Формула аспирина. Решение задач
Формула аспирина. Решение задач Презентация на тему Менделеев Дмитрий Иванович
Презентация на тему Менделеев Дмитрий Иванович  Витамины. (10 класс)
Витамины. (10 класс) Гордость земли Большемурашкинской: Владимир Васильевич Марковников
Гордость земли Большемурашкинской: Владимир Васильевич Марковников Пластмассы. Классификация
Пластмассы. Классификация Карбоновые кислоты
Карбоновые кислоты Механизмы двухсубстатных реакций
Механизмы двухсубстатных реакций Непредельные углеводороды
Непредельные углеводороды Типы химических реакций
Типы химических реакций Химический элемент Ferrum(2,3)
Химический элемент Ferrum(2,3) Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів
Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів