Содержание
- 2. 1.1 РАСЧЁТ СОСТАВА РАВНОВЕСНОЙ СМЕСИ 1. Рассчитайте тепловой эффект реакции А (табл.3.4) (кДж) при условии, что
- 3. 7. Рассчитайте константу равновесия Ка реакции А при температурах 298 К и Т. Выразите в общем
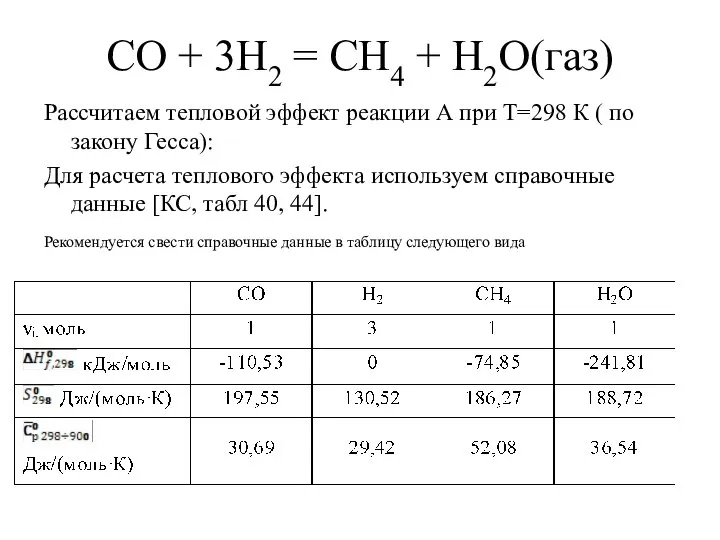
- 4. СО + 3Н2 = СН4 + Н2О(газ) Рассчитаем тепловой эффект реакции А при Т=298 К (
- 5. Тепловой эффект при 298 К: Определим изменение энтропии в ходе химической реакции при 298 К Определим
- 6. Определим тепловой эффект при заданной температуре Т=900 К для нашей реакции. Тепловой эффект при заданной температуре
- 7. Определим изменение энергии Гиббса при Т = 298 К и Т = 900 К и давлении
- 8. Для выражения константы равновесия через химическую переменную составим следующую таблицу Величина химической переменной связана с уравнением
- 9. Связь между константами Ка ,Кр и Кn выглядит следующим образом: для нашей реакции выражение константы равновесия
- 10. Изменение стехиометрических коэффициентов в процессе реакции: Определим глубину превращения для реакции А при стехиометрическом соотношении исходных
- 11. Определим глубину превращения при Т = 298К и Т = 900К для реакции А при р
- 12. Выражение для константы равновесия при р = 1 атм
- 13. Расчет степени превращения исходных веществ Расчёт равновесного выхода продуктов реакции Определим равновесный состав (в мольных долях)
- 14. 1.2. Гетерогенная реакция. Определение парциального давления
- 15. Fe + CO2 = FeO + CO Рассчитаем тепловой эффект реакции Х при температуре 298 К.
- 16. Рассчитаем изменение энтропии при Т = 298 К Определим изменение стандартной энергии Гиббса при Т =
- 18. Скачать презентацию














 Основные принципы работы химических сенсоров
Основные принципы работы химических сенсоров Истина - дочь времени, а не авторитета
Истина - дочь времени, а не авторитета Магний - активный, но под защитой
Магний - активный, но под защитой Подгруппа кислорода. Решение экспериментальных задач
Подгруппа кислорода. Решение экспериментальных задач Состав и свойства нефти. Химический состав нефтяной смеси
Состав и свойства нефти. Химический состав нефтяной смеси Презентация на тему Основные химические понятия
Презентация на тему Основные химические понятия  564481
564481 Пластмассы
Пластмассы Презентация по Химии "Соединения алюминия"
Презентация по Химии "Соединения алюминия"  Материаловедение. Деформация и разрушение материалов. (Тема 4)
Материаловедение. Деформация и разрушение материалов. (Тема 4) Окислительновосстановительные реакции. 9 класс
Окислительновосстановительные реакции. 9 класс Презентация на тему Классификация химических реакций
Презентация на тему Классификация химических реакций  Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В.
Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В. Химическая связь
Химическая связь _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1) V группа. Побочная подгруппа
V группа. Побочная подгруппа Организация физической защиты ДРМ
Организация физической защиты ДРМ Кислород и озон
Кислород и озон Выращивание кристаллов соли (домашний эксперимент)
Выращивание кристаллов соли (домашний эксперимент) Сплавы металлов
Сплавы металлов Вода - самое удивительное вещество в природе. (8 класс)
Вода - самое удивительное вещество в природе. (8 класс) Бутлєров
Бутлєров Взаимодействие молекул (7 класс)
Взаимодействие молекул (7 класс) Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ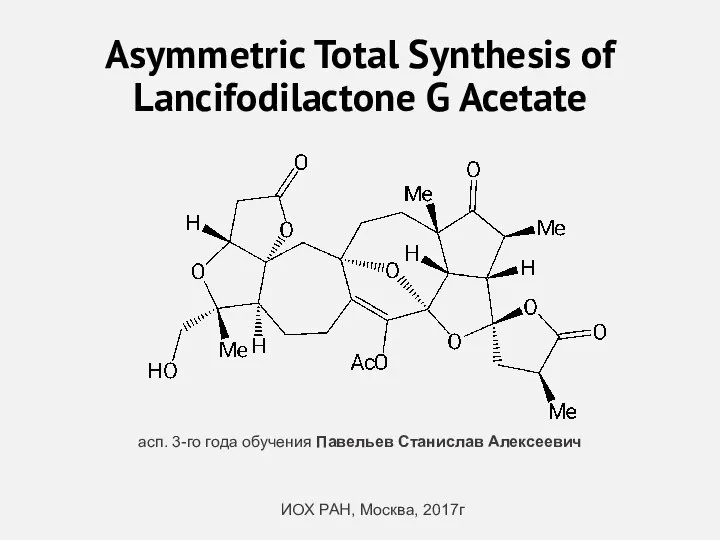 Asymmetric Total Synthesis of Lancifodilactone G Acetate
Asymmetric Total Synthesis of Lancifodilactone G Acetate Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Дисперсные системы
Дисперсные системы Основания. 8 класс
Основания. 8 класс