Аммиак. Состав. Строение. Химическая ковалентная полярная связь. Кристаллическая молекулярная решетка
Содержание
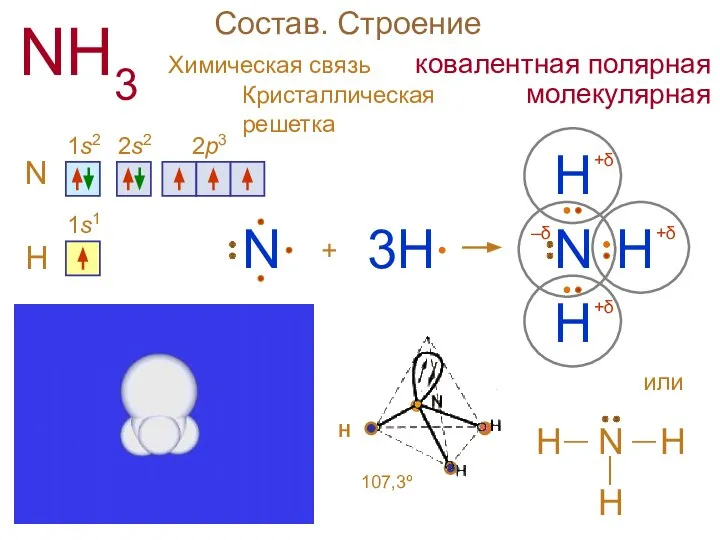
- 2. Состав. Строение NH3 N 1s2 2s2 2p3 + H N H H 3H H N 1s1
- 3. Физические свойства Аммиак – бесцветный газ с резким характерным запахом, легче воздуха. Определите плот бесцветный газ;
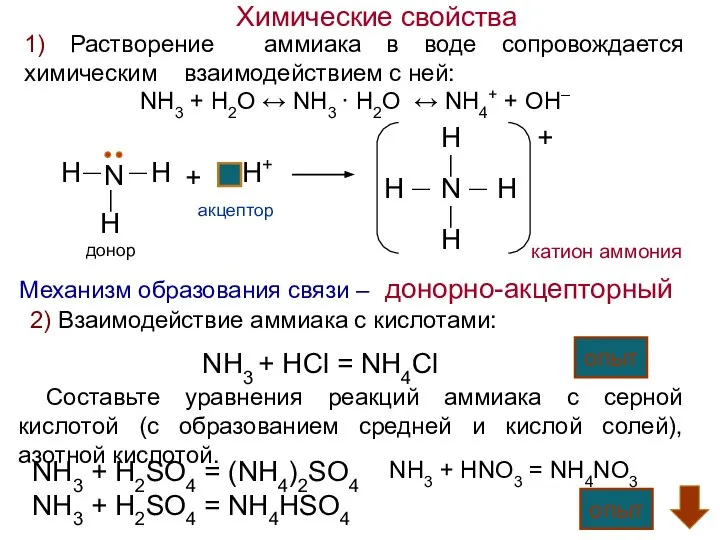
- 4. Химические свойства NH3 + H2O ↔ NH3 · H2O ↔ NH4+ + OH– 1) Растворение аммиака
- 5. Применение аммиака 1. Производство пластмасс и волокон 2. В составе моющих средств 4. В сельском хозяйстве
- 6. NH3 1 4 2 3 5 6 7
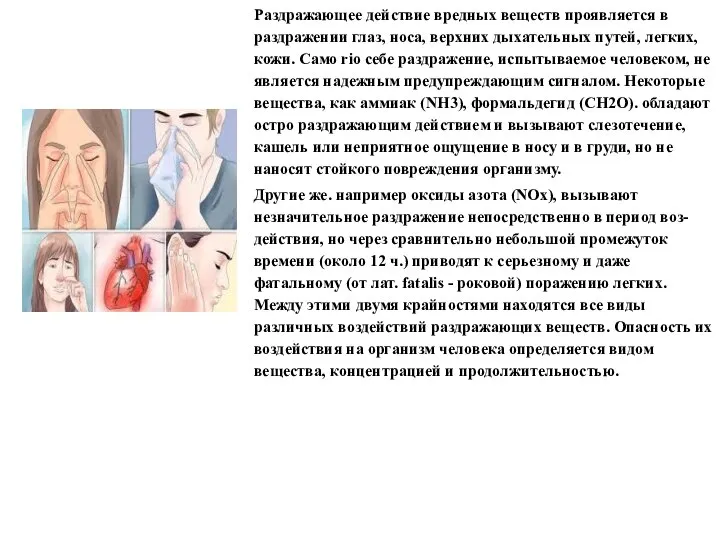
- 7. Раздражающее действие вредных веществ проявляется в раздражении глаз, носа, верхних дыхательных путей, легких, кожи. Само rio
- 9. Скачать презентацию



 Презентация на тему Роль йода в организме
Презентация на тему Роль йода в организме  Химическая кинетика
Химическая кинетика Аналитический подход к моделированию. Физико-химическое моделирование
Аналитический подход к моделированию. Физико-химическое моделирование Образовательный конкурс Химия - это?! II тур Химия – это практично
Образовательный конкурс Химия - это?! II тур Химия – это практично Fyzikálne a chemické deje
Fyzikálne a chemické deje Презентация на тему Моющие средства
Презентация на тему Моющие средства  Типы химической связи и виды кристаллических решеток
Типы химической связи и виды кристаллических решеток Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М
Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М Типы кристаллических решеток
Типы кристаллических решеток Периодический закон Д.И.Менделеева
Периодический закон Д.И.Менделеева 11_PERMANGANATOMETRIYa_JODOMETRIYa_1
11_PERMANGANATOMETRIYa_JODOMETRIYa_1 Презентация на тему Теллур
Презентация на тему Теллур  химия
химия Тема урока «Ионная связь»
Тема урока «Ионная связь» Презентация по Химии "Химические задачи как средство гуманизации обучения учащихся на уроках химии"
Презентация по Химии "Химические задачи как средство гуманизации обучения учащихся на уроках химии"  Домашняя работа по теме Фенол
Домашняя работа по теме Фенол Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год
Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год Простые вещества – металлы и неметаллы
Простые вещества – металлы и неметаллы Химическая связь
Химическая связь Мыла и синтетические
Мыла и синтетические Индикаторная бумага
Индикаторная бумага Реакционная способность химических соединений. Лекция 9
Реакционная способность химических соединений. Лекция 9 Взаимодействие кислот с металлами. Кислоты-окислители
Взаимодействие кислот с металлами. Кислоты-окислители Классификация неорганических веществ
Классификация неорганических веществ Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Вуглеводи. Групи
Вуглеводи. Групи Белки молока и молочных продуктов. Виды белков
Белки молока и молочных продуктов. Виды белков Газовые законы
Газовые законы