Слайд 2Положение в периодической системе
Железо - это d- элемент VIII группы; порядковый номер

– 26; атомная масса Ar(Fe) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
Схема строения атома:
Электронная формула: 1s22s22p63s23p63d64s2
Слайд 43. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗА
Запомнить!
Степень окисления +2 железо проявляет при взаимодействии со

слабыми окислителями: серой, йодом, соляной кислотой, растворами солей.
Степень окисления +3 железо проявляет при взаимодействии с сильными окислителями: хлором, бромом.
Слайд 5Fe + CuSO4= FeSO4 + Cu
2Fe+3Br2=2FeBr3

Слайд 6В лабораторных условиях железо можно получить из его соединений следующими способами:
восстановление железа
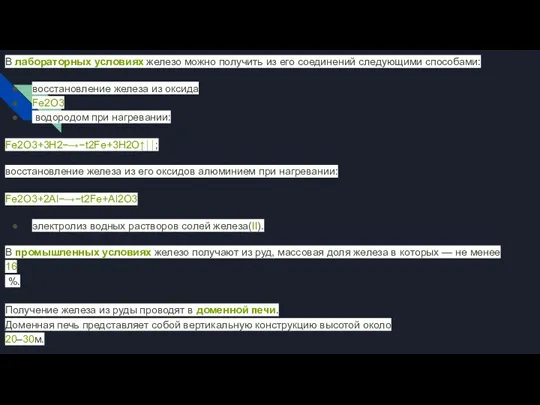
из оксида
Fe2O3
водородом при нагревании:
Fe2O3+3H2−→−t2Fe+3H2O↑⏐⏐;
восстановление железа из его оксидов алюминием при нагревании:
Fe2O3+2Al−→−t2Fe+Al2O3
электролиз водных растворов солей железа(II).
В промышленных условиях железо получают из руд, массовая доля железа в которых — не менее
16
%.
Получение железа из руды проводят в доменной печи.
Доменная печь представляет собой вертикальную конструкцию высотой около
20–30м.
Слайд 7Применение железа
В виде чугуна и стали железо находит широкое применение в народном

хозяйстве. Хлорид железа(III) используется при травлении медных плат, а сульфат железа(III) – в качестве хлопьеобразователя (коагулянта) при очистке воды. Ферриты двухвалентных металлов (магния, цинка, кобальта, никеля) со структурой шпинели применяют в радиоэлектронике, вычислительной технике.
Соли железа(III) образуют желто-коричневые растворы, цвет которых объясняется гидролизом, приводящим к образованию коллоидного раствора гидроксида железа(III). Многие из них, например, хлорид FeCl3×6H2O («хлорное железо») сильно гигроскопичны, и при хранении в неплотно закрытых склянках, отсыревают.






 Klas_kh_r_-ur_-urok1
Klas_kh_r_-ur_-urok1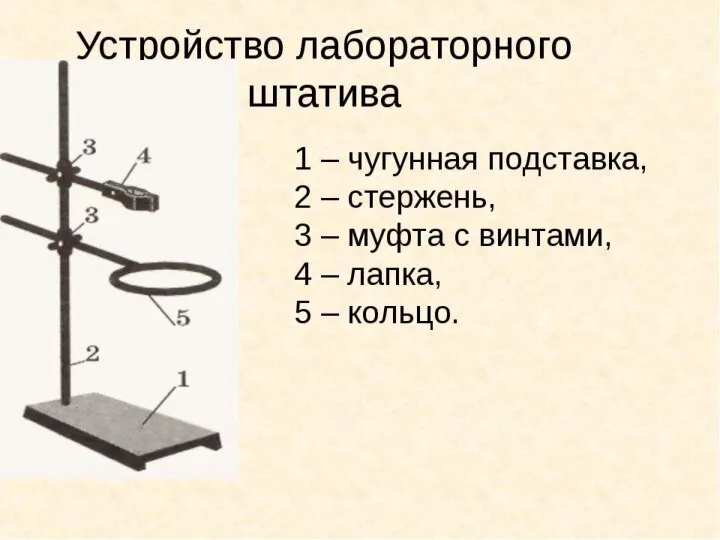 Устройство лабораторного штатива
Устройство лабораторного штатива Презентация на тему Роль химии в жизни общества
Презентация на тему Роль химии в жизни общества  Презентация на тему Электролиты
Презентация на тему Электролиты  Триметилалюминий
Триметилалюминий Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Щелочные металлы и их соединения
Щелочные металлы и их соединения Основные понятия химической кинетики. Скорость химической реакции
Основные понятия химической кинетики. Скорость химической реакции Периодическая система Д. И. Менделеева. Знаки химических элементов
Периодическая система Д. И. Менделеева. Знаки химических элементов Комплексные соли. 11 класс
Комплексные соли. 11 класс Полный синтез метилового эфира - пенталенолактона
Полный синтез метилового эфира - пенталенолактона Химия и краски
Химия и краски Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Взвешивание. Аналитические весы
Взвешивание. Аналитические весы Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Блок-схема функциональных элементов клеточного метаболизма
Блок-схема функциональных элементов клеточного метаболизма Состав и строение атома. Изотопы
Состав и строение атома. Изотопы Классификация органических реакций, реагентов
Классификация органических реакций, реагентов Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы Состояния вещества. Тест. 5 класс
Состояния вещества. Тест. 5 класс Вуглеводи. Групи
Вуглеводи. Групи К решению задач по диссоциации
К решению задач по диссоциации Ароматические системы
Ароматические системы Углеводороды: соединения, состоящие из углерода и водорода
Углеводороды: соединения, состоящие из углерода и водорода Тема: Неметаллы
Тема: Неметаллы Презентация на тему Ролевая игра "Суд над этанолом"
Презентация на тему Ролевая игра "Суд над этанолом"  Олигосахариды и полисахариды
Олигосахариды и полисахариды Исследование химического состава разных сортов картофеля
Исследование химического состава разных сортов картофеля