Содержание
- 2. Зачем необходимо определять влагу в лекарственных средствах В фармацевтическом анализе определение летучих веществ и воды имеет
- 3. Промышленное значение определения влаги Кроме фармацевтических лабораторий определение влаги широко применяется в сельском хозяйстве для определения
- 4. Метод титрования реактивом К. Фишера – классический метод титрования в аналитической химии - получил наиболее широкое
- 5. Метод титрования реактивом К. Фишера Плюсы метода: Высокая точность определения при малых навесках субстанций, в отличие
- 6. Метод титрования реактивом К. Фишера Ограничения метода: Неприменим для анализа соединений, реагирующих с одним или несколькими
- 7. Метод титрования реактивом К. Фишера Реактив К. Фишера: Представляет собой раствор двуокиси серы, йода и пиридина
- 8. Метод титрования реактивом К. Фишера
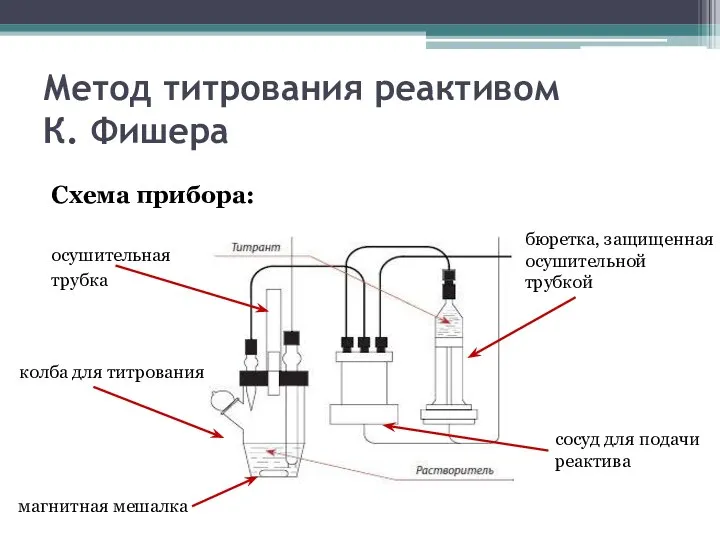
- 9. Метод титрования реактивом К. Фишера Схема прибора: осушительная трубка бюретка, защищенная осушительной трубкой сосуд для подачи
- 10. Метод титрования реактивом К. Фишера Фото приборов:
- 11. Метод титрования реактивом К. Фишера Методика определения: Точную навеску препарата, содержащую приблизительно от 0,03 до 0,05
- 12. Метод титрования реактивом К. Фишера Методика определения: Конец титрования может быть определен как визуально по изменению
- 13. Метод титрования реактивом К. Фишера
- 14. Метод титрования реактивом К. Фишера Приготовление реактива: Имеющийся в продаже реактив К. Фишера (ТУ 6-09-1487-76) состоит
- 15. Метод титрования реактивом К. Фишера Установка титра: Около 0,04 г воды (точная навеска) вносят в сухую
- 16. Метод титрования реактивом К. Фишера
- 17. Метод титрования реактивом К. Фишера Пример: АРБИДОЛ (ГФ РФ XII изд., ФС 42-0216-07) Вода. Не менее
- 18. Жиры, масла, воски общая характеристика качества Свойства жиров определяются качественным составом жирных кислот, их количественным соотношением,
- 19. Кислотное число количество миллиграммов едкого кали, необходимое для нейтрализации свободных кислот, содержащихся в 1 г исследуемого
- 20. Кислотное число Методика определения: Около 10 г испытуемого вещества, растворяют в 50 мл смеси равных объемов
- 21. Кислотное число
- 22. Число омыления - количество миллиграммов едкого кали, необходимое для нейтрализации свободных кислот и кислот, образующихся при
- 23. Число омыления Является одним из показателей подлинности жирных масел. В жирах и маслах, содержащих, преимущественно, триглицериды,
- 24. Число омыления Методика определения: Около 2 г испытуемого вещества (точная навеска) помещают в колбу емкостью 200-250
- 25. Число омыления Методика определения: Сняв холодильник, прибавляют 1 мл раствора фенолфталеина и 25 мл свежепрокипяченной горячей
- 26. Число омыления
- 27. Определение азота аминокислот методом формольного титрования Аминные группы аминокислот вступают в реакцию с формальдегидом с образованием
- 28. Определение азота аминокислот методом формольного титрования По количеству раствора щелочи, израсходованному на титрование, можно рассчитать содержание
- 29. Йодометрическое определение азота аминокислот Цистеин определяют йодометрически способом обратного титрования, затем избыток йода оттитровывают стандартным раствором
- 31. Скачать презентацию



























 Соли Na2SO4
Соли Na2SO4 Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Презентация на тему Галогены
Презентация на тему Галогены  Презентация на тему Классы неорганических веществ. Электролитическая диссоциация
Презентация на тему Классы неорганических веществ. Электролитическая диссоциация  Магнитный момент атома. Периодическая система элементов Д.И. Менделеева
Магнитный момент атома. Периодическая система элементов Д.И. Менделеева Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Плавленые сыры без фосфатов
Плавленые сыры без фосфатов Prezentatsia1_1 (1)
Prezentatsia1_1 (1) Строение атома
Строение атома Планетарная модель атома и его строение
Планетарная модель атома и его строение Составитель: Денисова В.Г.
Составитель: Денисова В.Г. Кислоты и соли
Кислоты и соли Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены Триметилалюминий
Триметилалюминий Биотит и тальк
Биотит и тальк Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Электроны в кристаллах. Квантовая теория свободных электронов в металлах
Электроны в кристаллах. Квантовая теория свободных электронов в металлах Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Строение органических соединений
Строение органических соединений Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Альдегиды и кетоны
Альдегиды и кетоны Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Сера и ее соединения
Сера и ее соединения Белки
Белки Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота