Содержание
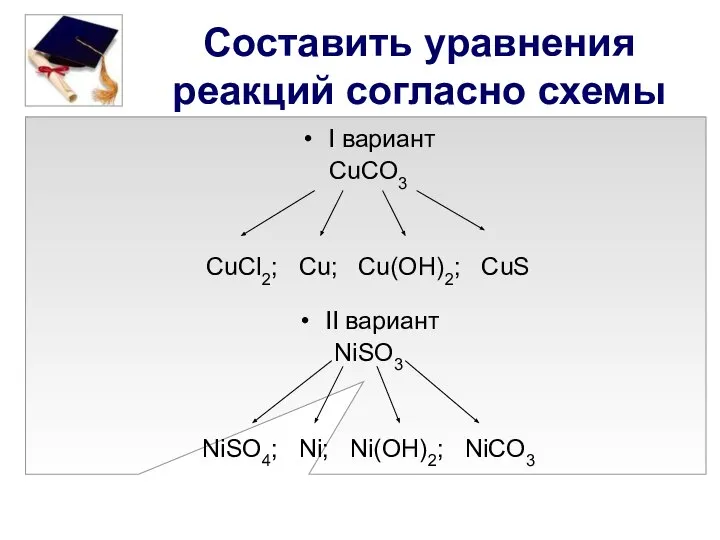
- 2. Составить уравнения реакций согласно схемы I вариант CuCO3 CuCl2; Cu; Cu(OH)2; CuS II вариант NiSO3 NiSO4;
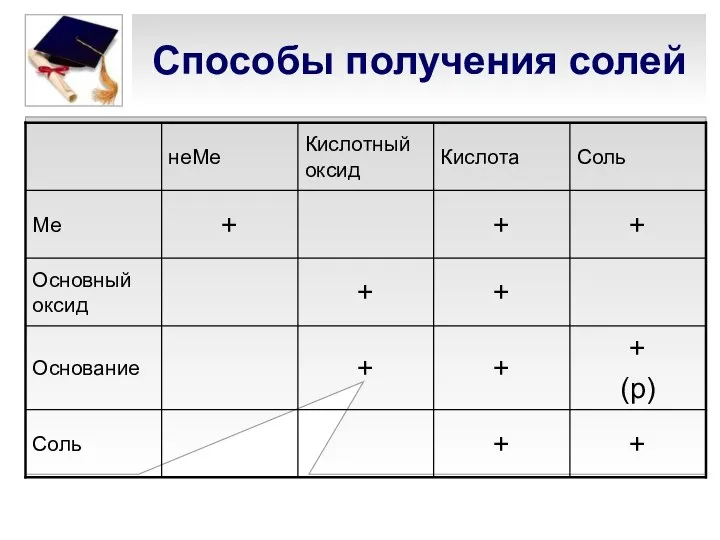
- 3. Способы получения солей
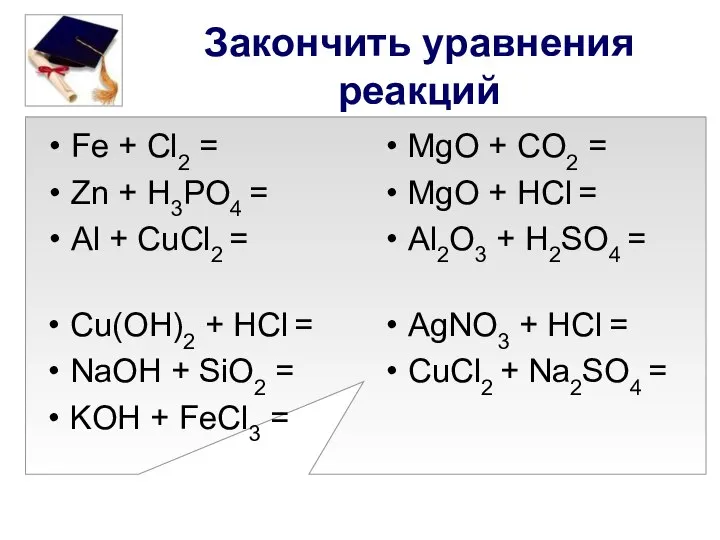
- 4. Закончить уравнения реакций Fe + Cl2 = Zn + H3PO4 = Al + CuCl2 = MgO
- 5. Составьте уравнения реакций нейтрализации, в результате которых образуются следующие соли. Хлорид Al Сульфат Ba Нитрат Ba
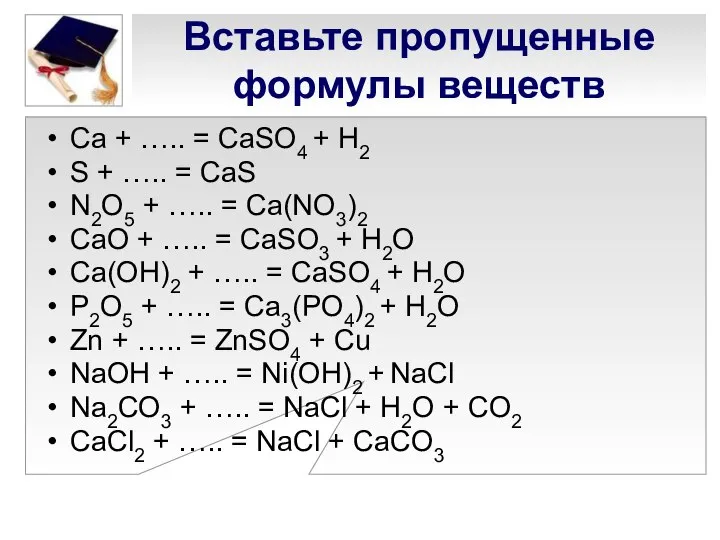
- 6. Вставьте пропущенные формулы веществ Ca + ….. = CaSO4 + H2 S + ….. = CaS
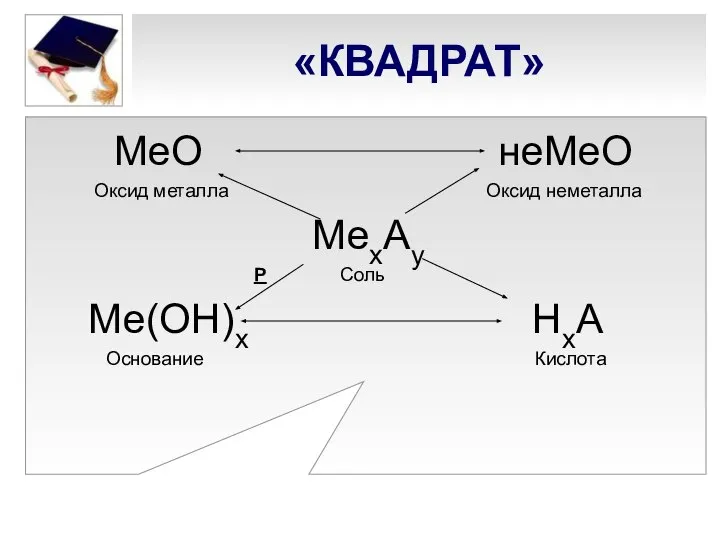
- 7. «КВАДРАТ» МеО неМеО Оксид металла Оксид неметалла МехАу Р Соль Ме(ОН)х НхА Основание Кислота
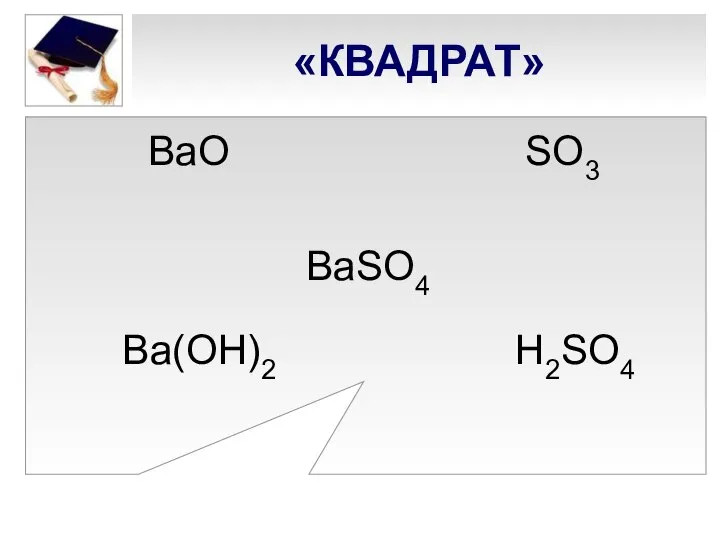
- 8. «КВАДРАТ» BaО SО3 BaSO4 Ba(ОН)2 Н2SO4
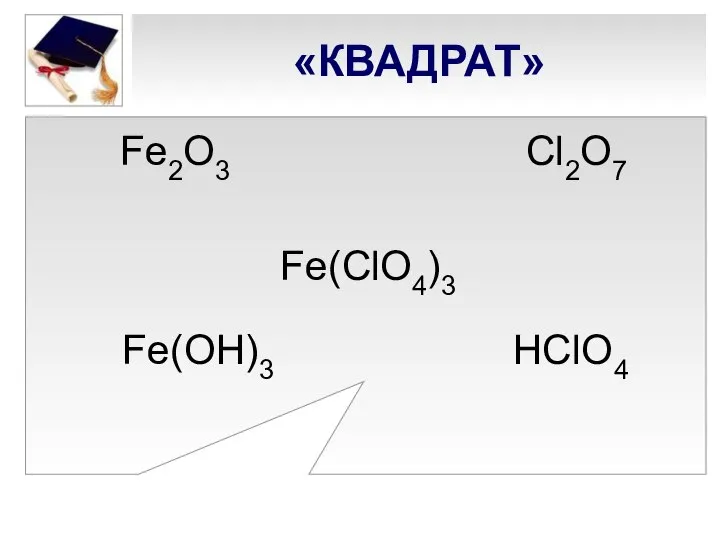
- 9. «КВАДРАТ» Fe2O3 Cl2О7 Fe(ClO4)3 Fe(ОН)3 НClO4
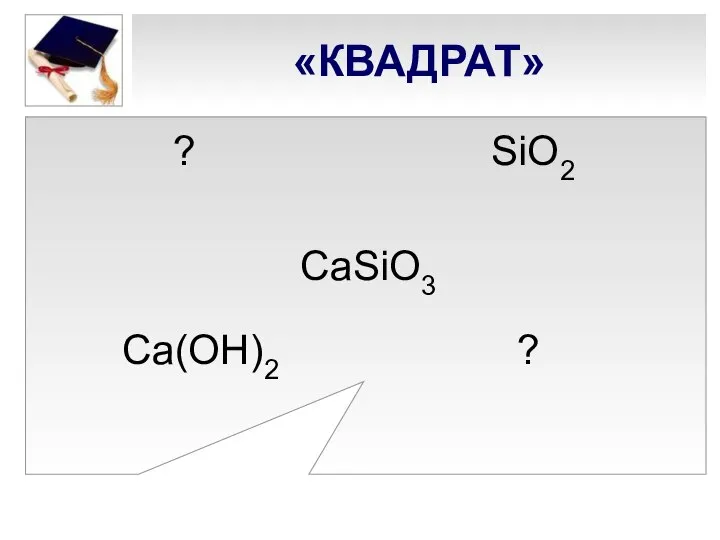
- 10. «КВАДРАТ» ? SiО2 CaSiO3 Ca(ОН)2 ?
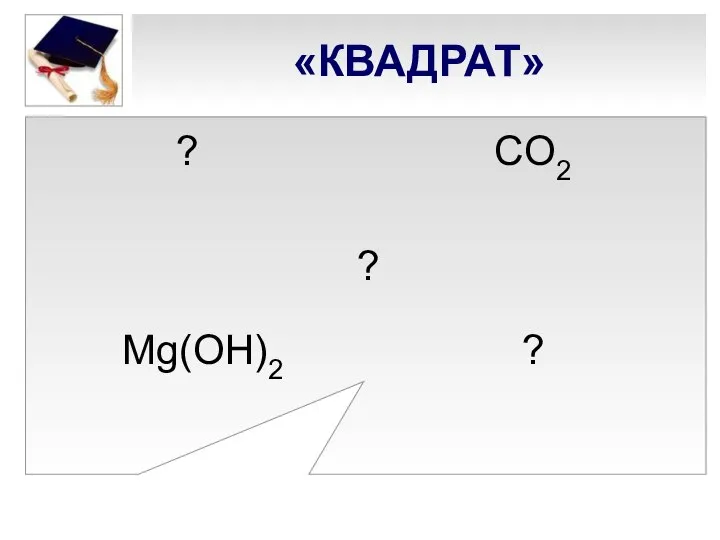
- 11. «КВАДРАТ» ? CО2 ? Mg(ОН)2 ?
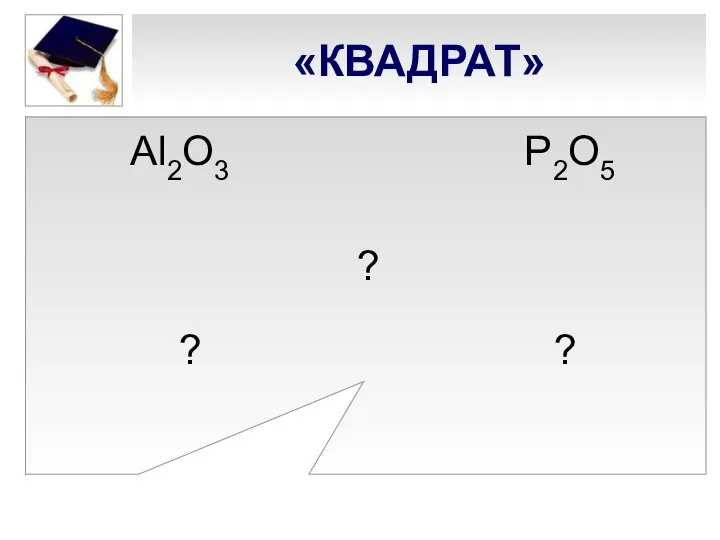
- 12. «КВАДРАТ» Al2O3 P2О5 ? ? ?
- 14. Скачать презентацию

 Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия
Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия Реакции разложения
Реакции разложения Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А.
Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А. Органическая геохимия
Органическая геохимия Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Подгруппа алюминия
Подгруппа алюминия Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро
Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро Химическое ассорти
Химическое ассорти Галогены
Галогены Презентация на тему Кислоты
Презентация на тему Кислоты  Презентация по Химии "Фиолетовый проказник"
Презентация по Химии "Фиолетовый проказник"  Презентация на тему: Изомерия
Презентация на тему: Изомерия Карбоновые кислоты
Карбоновые кислоты Алканы. Строение и изомерия
Алканы. Строение и изомерия ТЕСТ "Дисперсные системы"
ТЕСТ "Дисперсные системы" Окислительно-восстановительные реакции. Лекция №7
Окислительно-восстановительные реакции. Лекция №7 Алканы
Алканы Физическая химия, термодинамика
Физическая химия, термодинамика Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Общая характеристика металлов
Общая характеристика металлов Щелочноземельные металлы
Щелочноземельные металлы Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Якісні реакції органічних речовин
Якісні реакції органічних речовин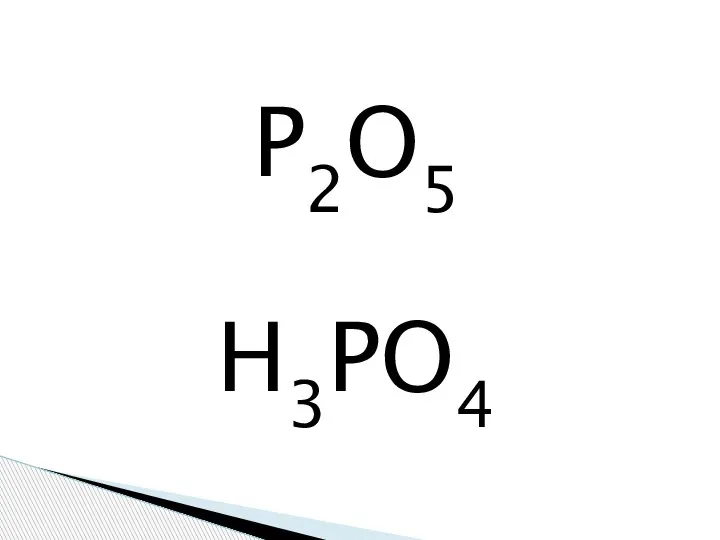 Фосфорная кислота
Фосфорная кислота Липиды. Состав липидов
Липиды. Состав липидов Безопасно ли пить воду из водопроводного крана?
Безопасно ли пить воду из водопроводного крана? Gelation in aqueous solution of L-cysteine and silver nitrate
Gelation in aqueous solution of L-cysteine and silver nitrate