Содержание
- 2. Основные обозначения m – масса (кг); F – сила (Н); s – площадь (м2); V- объём
- 3. Содержание Основные понятия Физическое тело (тело) – любой отдельно взятый предмет. Рабочее тело – вещество, используемое
- 4. Моль – количество вещества, число структурных частиц которого равно числу атомов, содержащихся в углероде массой 0,012
- 5. Температура – мера средней кинетической энергии молекул. t - температура по термодинамической шкале Цельсия (0С); Т
- 6. Молярная доля компонента смеси х – это величина, равная отношению количества вещества данного компонента к количеству
- 7. или единице, делённой на сумму отношений массовых долей компонентов к их молярным массам. М=1/Σ(ωi/Мi) Закон Дальтона.
- 8. Для газовой смеси по закону Дальтона справедливо: 1) каждый компонент газовой смеси, имеет температуру, равную температуре
- 9. Варианты практической работы №2
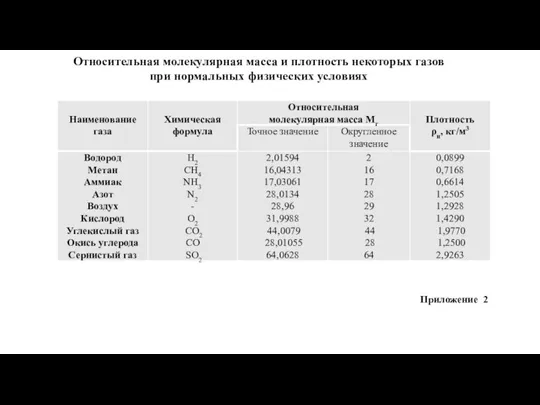
- 11. Относительная молекулярная масса и плотность некоторых газов при нормальных физических условиях Приложение 2
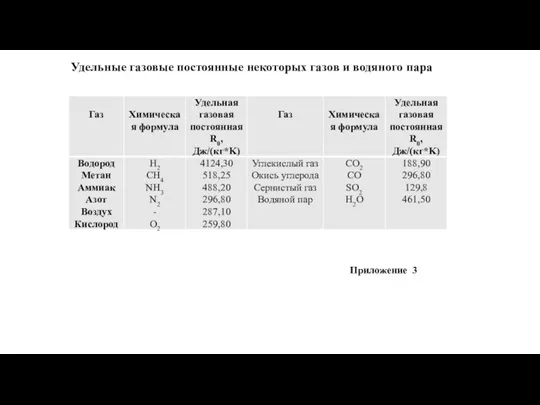
- 12. Удельные газовые постоянные некоторых газов и водяного пара Приложение 3
- 13. Исходные данные. Газ 1 CH4. Газ 2 CО . Приведенный объем V1 V1 =0,2 м3 .
- 14. Контрольное уравнение: х1+х2=0,181+0,819=1 Молярная масса смеси M=x1M1+ x2M2=(0,181·28,01+ 0,819·16,04) ·10-3 =5,29389 + 13,13676 · 10-3 Удельная
- 15. 1) состав смесей переменный 2.Вещества смесей сохраняют свои свойства:( Например:-кислород и водород газы: -кислород поддерживает горение
- 16. 2) Парциальное давление в газовой смеси. Мольная доля газов. Закон Дальтона (закон парциальных давлений). Парциальное давление
- 17. 3)Объeмной долей ri данного газа называется отношение объема, который занимал бы данный газ при температуре и
- 18. 4)В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и
- 20. Скачать презентацию















 Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Презентация на тему Химический состав клетки. Неорганические соединения
Презентация на тему Химический состав клетки. Неорганические соединения  Алкены. Строение, номенклатура, изомерия
Алкены. Строение, номенклатура, изомерия Презентация на тему Электролитическая диссоциация (8 класс)
Презентация на тему Электролитическая диссоциация (8 класс)  Стекло. Лекция №22
Стекло. Лекция №22 Презентация на тему Жизнь и деятельность Д.И. Менделеева
Презентация на тему Жизнь и деятельность Д.И. Менделеева  Коррозия металлов
Коррозия металлов Растворы. Часть 2
Растворы. Часть 2 Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота  Классы неорганических соединений
Классы неорганических соединений ZhK_Prezentatsia_1
ZhK_Prezentatsia_1 Липиды
Липиды Бромистый этил
Бромистый этил Углеводороды
Углеводороды Оксиды. Классификация
Оксиды. Классификация Валентность. Определение валентности элемента в оксиде
Валентность. Определение валентности элемента в оксиде Фенолы
Фенолы Электрохимия. Электролиты
Электрохимия. Электролиты Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Химия вокруг нас
Химия вокруг нас Алкены. Строение. Изомерия. Химические свойства. Получение
Алкены. Строение. Изомерия. Химические свойства. Получение Физическая и коллоидная химия
Физическая и коллоидная химия Парафины или алканы. Циклоалканы или нафтены
Парафины или алканы. Циклоалканы или нафтены Набор для выращивания монокристалла. Защита проекта
Набор для выращивания монокристалла. Защита проекта Кислородсодержащие органические вещества
Кислородсодержащие органические вещества Явления, смеси и способы их разделения
Явления, смеси и способы их разделения Круговорот азота в природе
Круговорот азота в природе Химические уравнения
Химические уравнения