Содержание
- 2. Ключевые понятия Реакционная способность - способность вещества вступать в ту или иную химическую реакцию и реагировать
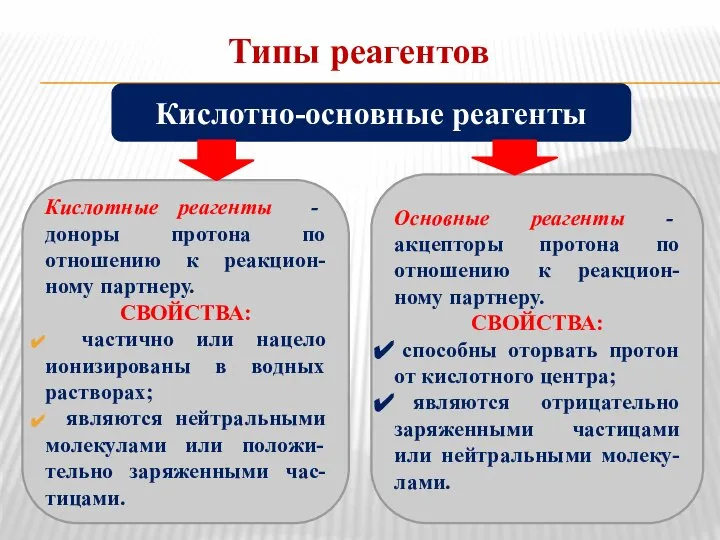
- 4. Типы реагентов Кислотные реагенты - доноры протона по отношению к реакцион-ному партнеру. СВОЙСТВА: частично или нацело
- 5. Типы реагентов Нуклеофилы - частицы, образую-щие новую ковалентную связь за счет своей электронной пары. СВОЙСТВА: обладают
- 6. Типы реагентов Радикалы - свободные атомы или частицы с неспаренным электроном. Символ R Окислители - нейтральные
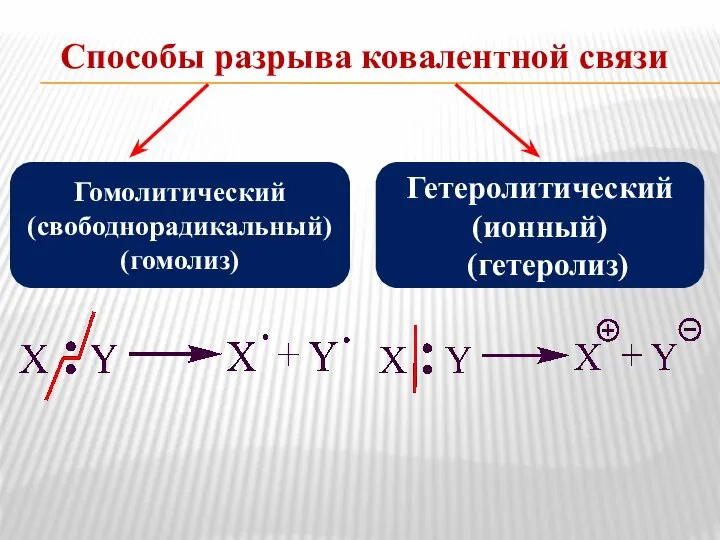
- 7. Способы разрыва ковалентной связи Гомолитический (свободнорадикальный) (гомолиз) Гетеролитический (ионный) (гетеролиз)
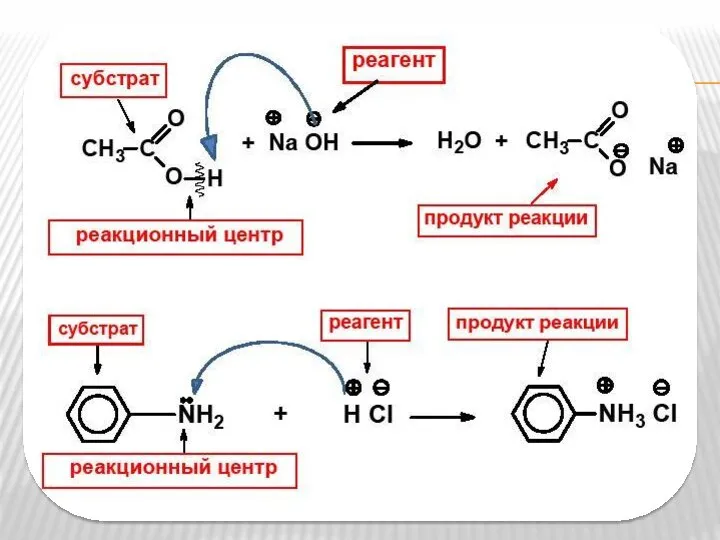
- 8. Признаки классификации органических реакций по характеру изменения связей в субстрате и реагенте; по типу реагента; по
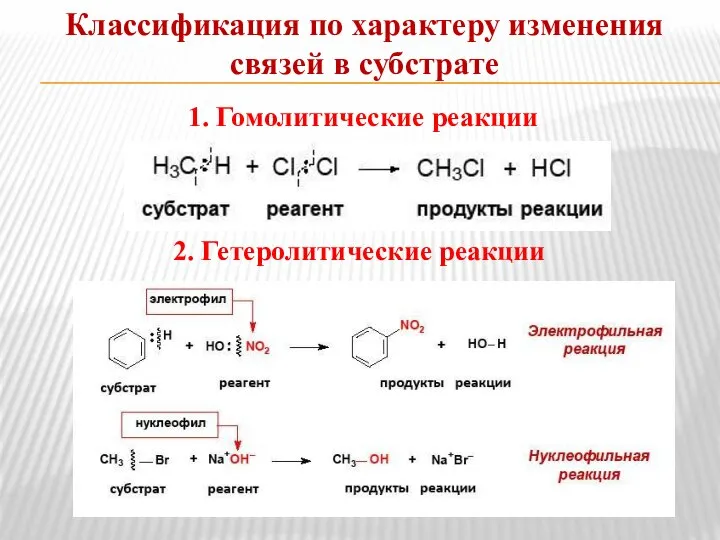
- 9. Классификация по характеру изменения связей в субстрате 1. Гомолитические реакции 2. Гетеролитические реакции
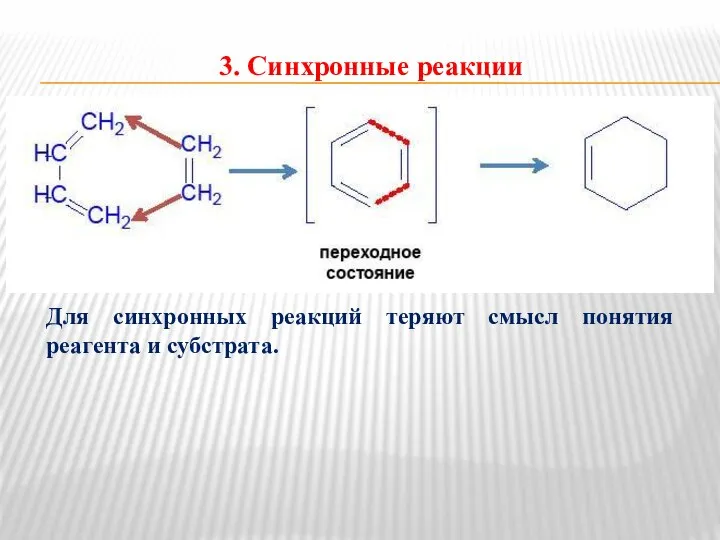
- 10. 3. Синхронные реакции Для синхронных реакций теряют смысл понятия реагента и субстрата.
- 11. Классификация по типу реагента Радикальные (R) Электрофильные (E) Нуклеофильные (N) Окислительные [O] Восстановительные [H]
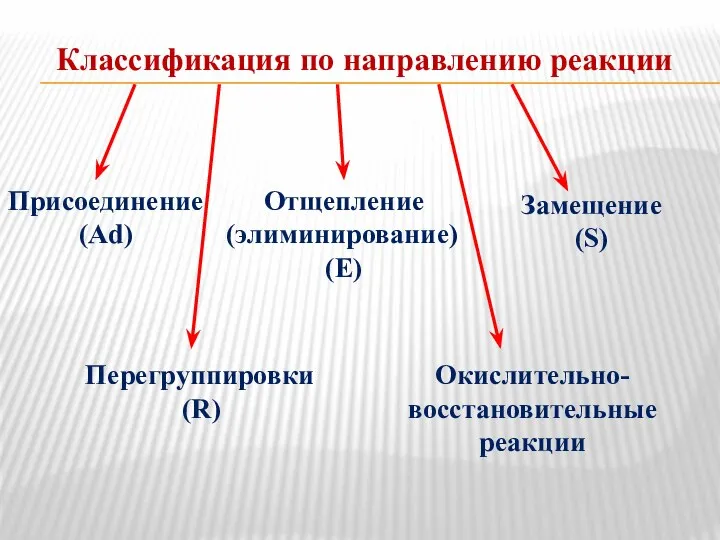
- 12. Классификация по направлению реакции Присоединение (Ad) Отщепление (элиминирование) (E) Замещение (S) Перегруппировки (R) Окислительно- восстановительные реакции
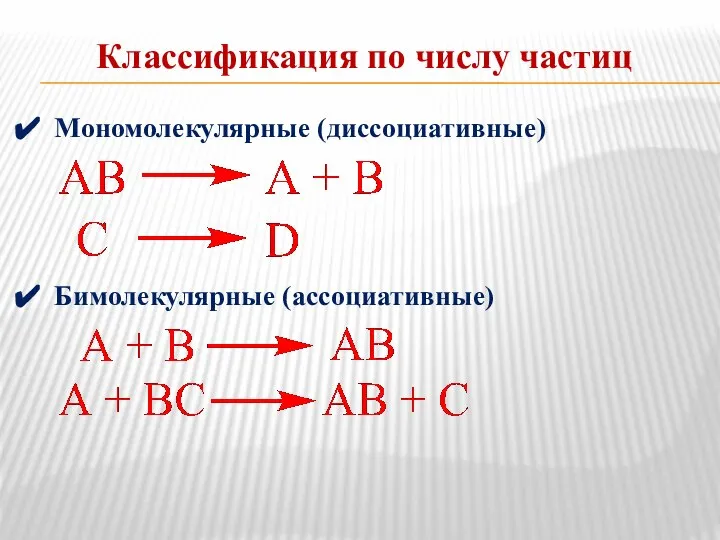
- 13. Классификация по числу частиц Мономолекулярные (диссоциативные) Бимолекулярные (ассоциативные)
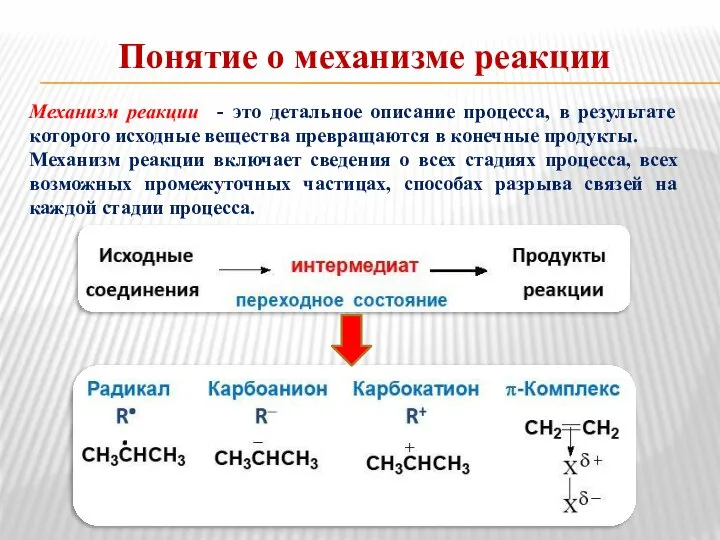
- 14. Понятие о механизме реакции Механизм реакции - это детальное описание процесса, в результате которого исходные вещества
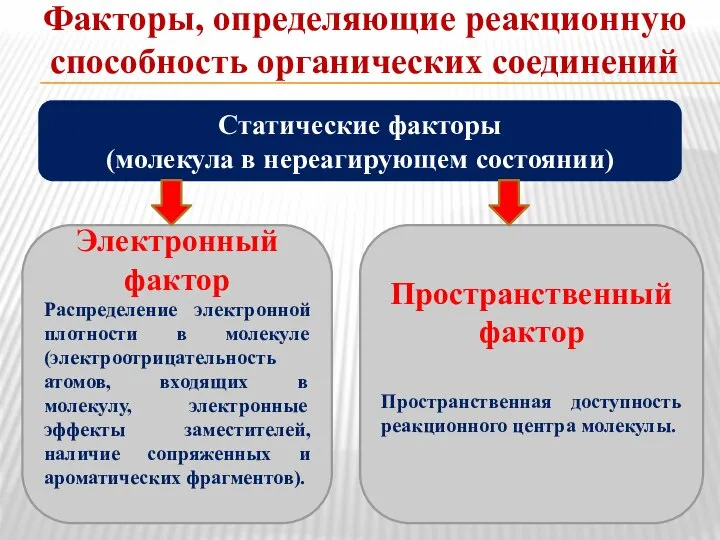
- 15. Факторы, определяющие реакционную способность органических соединений Статические факторы (молекула в нереагирующем состоянии) Электронный фактор Распределение электронной
- 16. Включают оценку энергии промежуточных частиц или переходного состояния. Чем больше возможностей для делокализации (рассредоточения) электронной плотности
- 18. Скачать презентацию




![Классификация по типу реагента Радикальные (R) Электрофильные (E) Нуклеофильные (N) Окислительные [O] Восстановительные [H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1152660/slide-10.jpg)

 Процессы переработки нефти
Процессы переработки нефти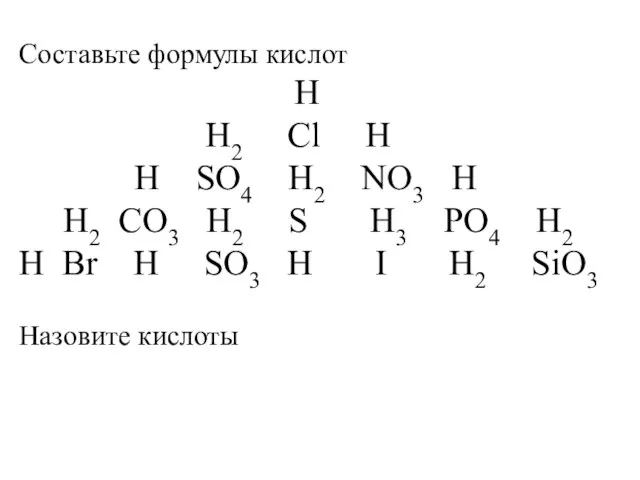 Составьте формулы кислот
Составьте формулы кислот ОГЭ ХИМИЯ 1
ОГЭ ХИМИЯ 1 Индикаторная бумага
Индикаторная бумага Влияние меди на коррозию низколегиованных сталей
Влияние меди на коррозию низколегиованных сталей Химический анализ. Исследовательская деятельность (8 класс)
Химический анализ. Исследовательская деятельность (8 класс) Углеводы. Тема 9
Углеводы. Тема 9 Карбоновые кислоты
Карбоновые кислоты Презентация на тему Характеристика высокомолекулярных соединений
Презентация на тему Характеристика высокомолекулярных соединений  Классификация неорганических веществ
Классификация неорганических веществ Судьба углеродного скелета аминокислот
Судьба углеродного скелета аминокислот Реакции разложения
Реакции разложения Основания (Ме+n(ОН)-n)
Основания (Ме+n(ОН)-n) Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата 4.1-2 Генетическая связь+
4.1-2 Генетическая связь+ Сухая вода помогла измерить поляризацию ковалентных связей
Сухая вода помогла измерить поляризацию ковалентных связей Алюминий и его соединения
Алюминий и его соединения Классы неорганических веществ. Типы химических реакций Конкурс знаний
Классы неорганических веществ. Типы химических реакций Конкурс знаний Аналитическая химия
Аналитическая химия Новое в ЕГЭ. Химия
Новое в ЕГЭ. Химия Chemsheets AS 1009 (Electron arrangement)
Chemsheets AS 1009 (Electron arrangement)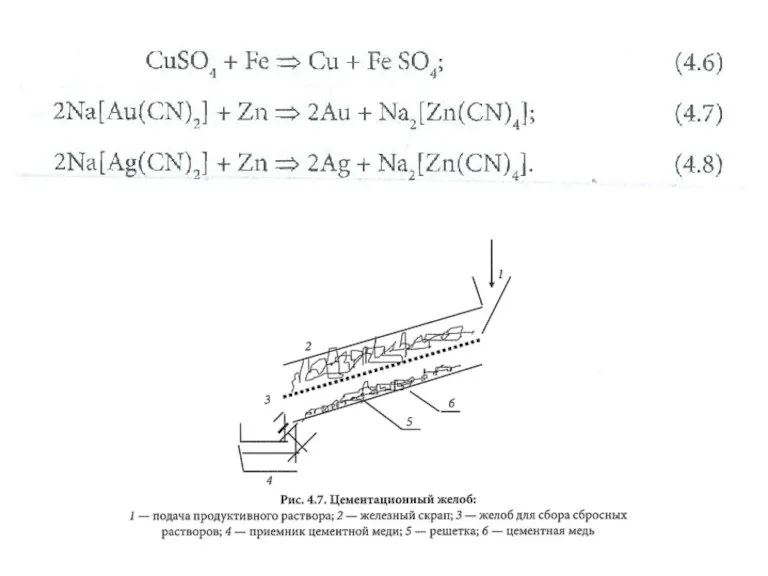 Гальванохимическая очистка. Сорбция
Гальванохимическая очистка. Сорбция Повторение по теме Химические реакции
Повторение по теме Химические реакции Жиры. Их классификация и свойства
Жиры. Их классификация и свойства Скорость химических реакций
Скорость химических реакций Кислоты основания и соли как электролиты
Кислоты основания и соли как электролиты Презентация на тему Общая характеристика подгруппы углерода
Презентация на тему Общая характеристика подгруппы углерода  Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы