Содержание
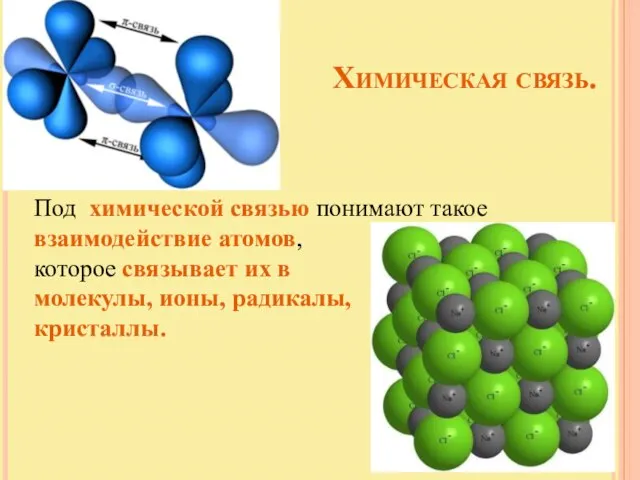
- 2. Химическая связь. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы,
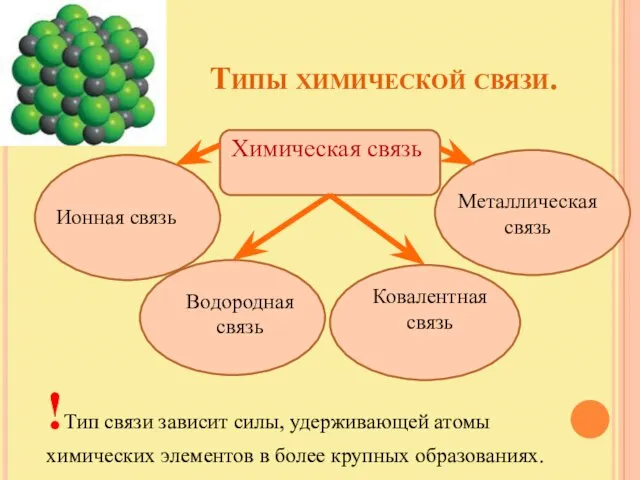
- 3. Типы химической связи. Химическая связь Ионная связь Металлическая связь Водородная связь Ковалентная связь !Тип связи зависит
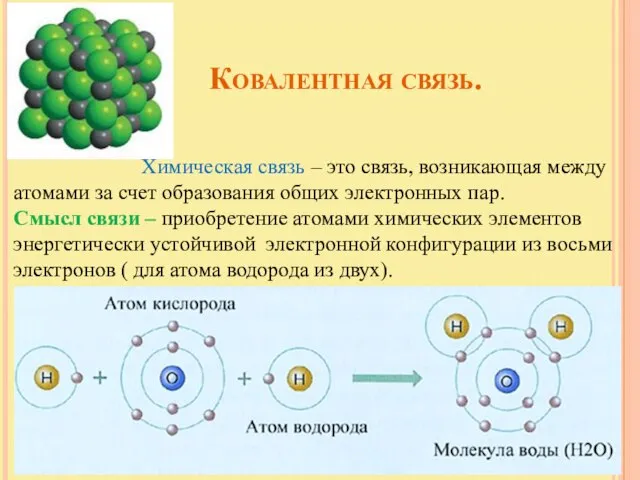
- 4. Ковалентная связь. Химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
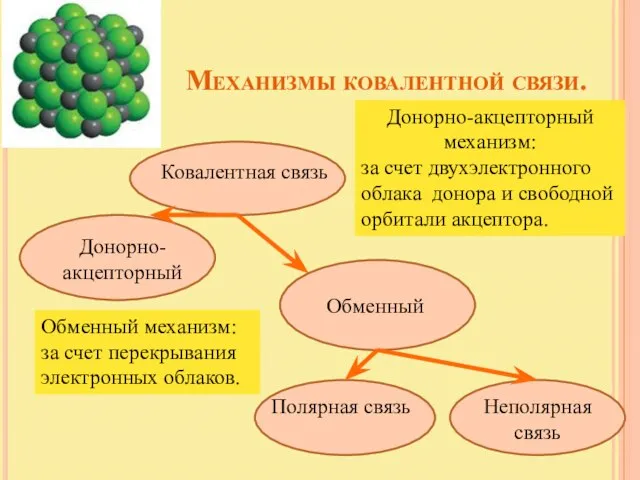
- 5. Механизмы ковалентной связи. Ковалентная связь Донорно-акцепторный Обменный Полярная связь Неполярная связь Обменный механизм: за счет перекрывания
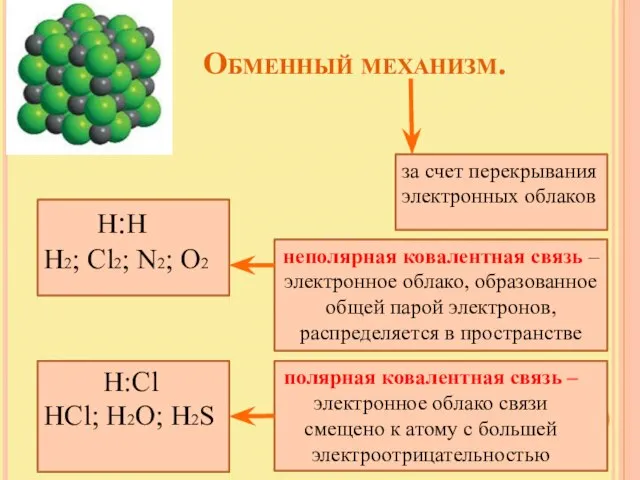
- 6. Обменный механизм. за счет перекрывания электронных облаков Н:Н Н2; Cl2; N2; O2 неполярная ковалентная связь –
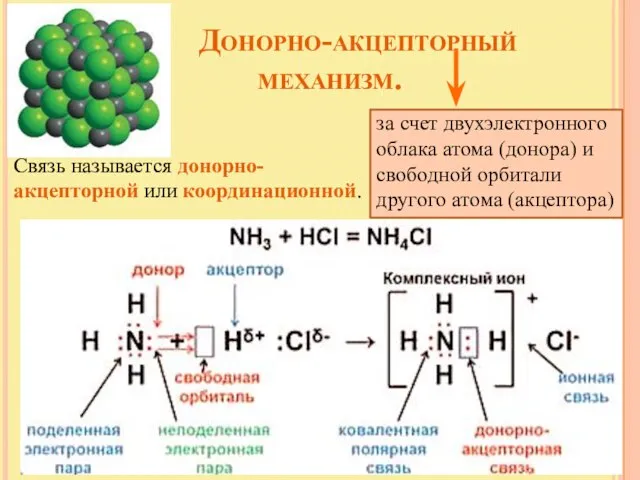
- 7. Донорно-акцепторный механизм. за счет двухэлектронного облака атома (донора) и свободной орбитали другого атома (акцептора) Связь называется
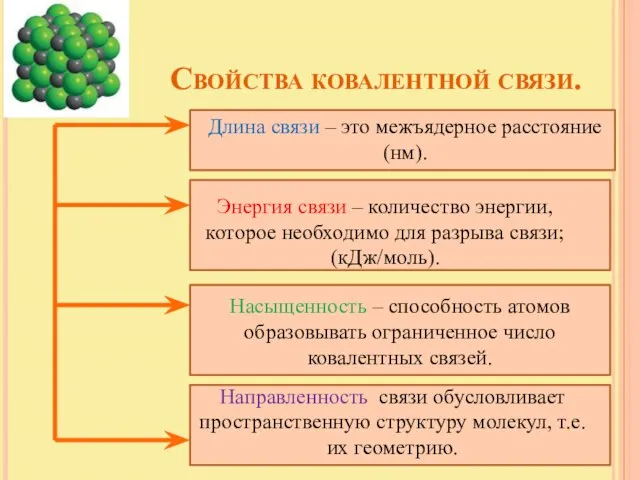
- 8. Свойства ковалентной связи. Длина связи – это межъядерное расстояние (нм). Энергия связи – количество энергии, которое
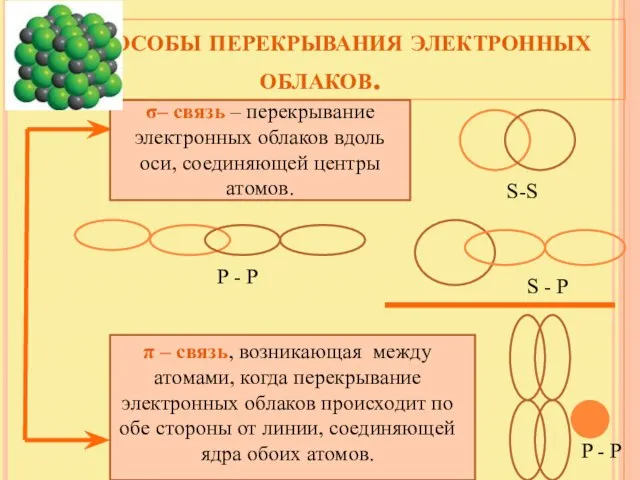
- 9. Способы перекрывания электронных облаков. σ– связь – перекрывание электронных облаков вдоль оси, соединяющей центры атомов. π
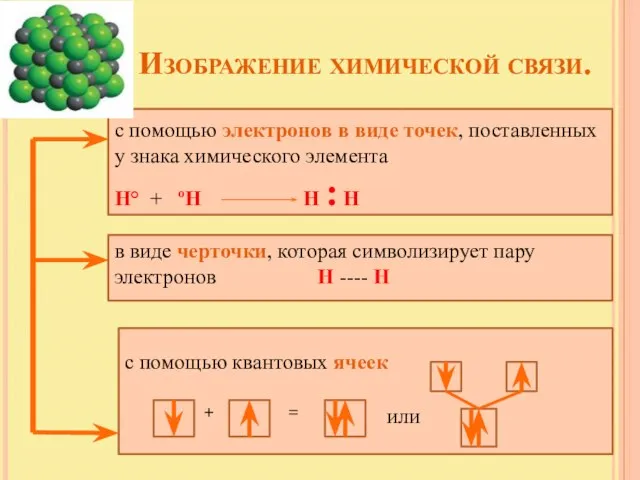
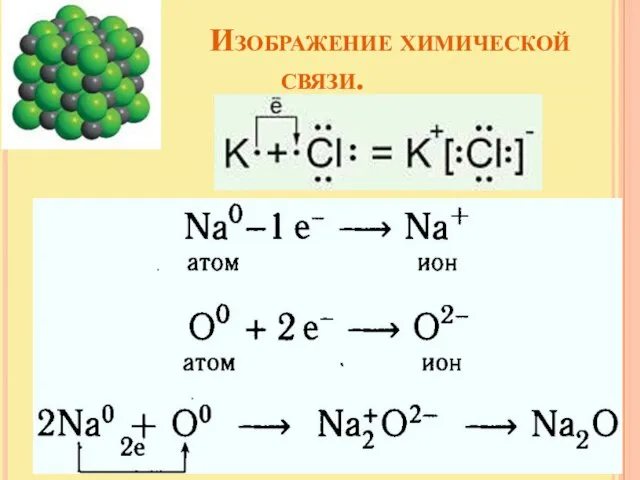
- 10. Изображение химической связи. с помощью электронов в виде точек, поставленных у знака химического элемента Н° +
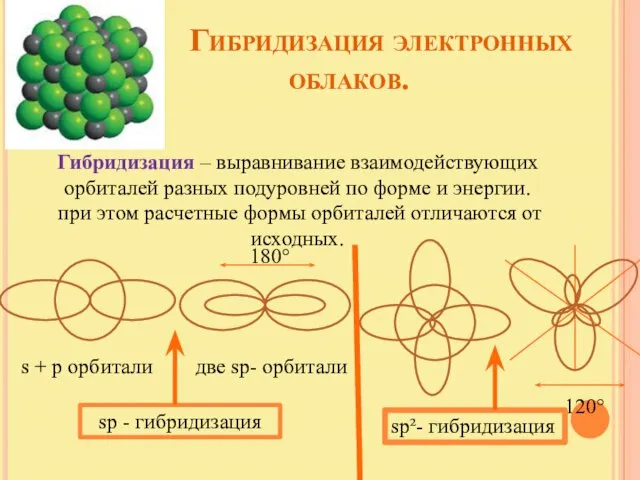
- 11. Гибридизация электронных облаков. Гибридизация – выравнивание взаимодействующих орбиталей разных подуровней по форме и энергии. при этом
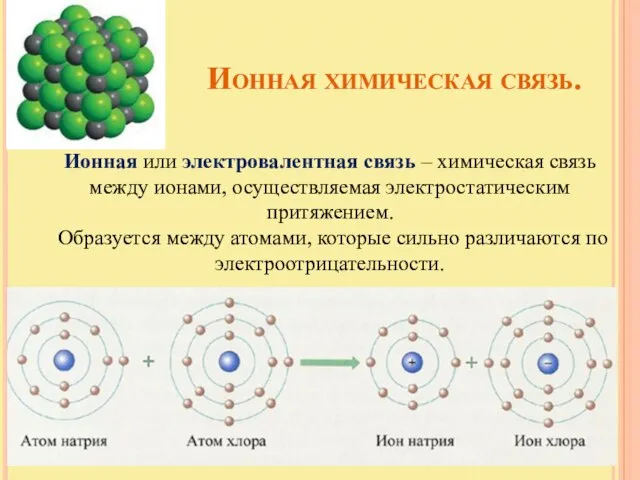
- 12. Ионная химическая связь. Ионная или электровалентная связь – химическая связь между ионами, осуществляемая электростатическим притяжением. Образуется
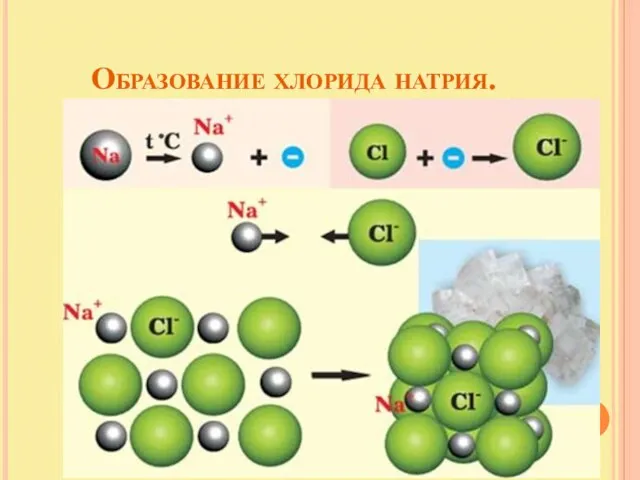
- 13. Образование хлорида натрия.
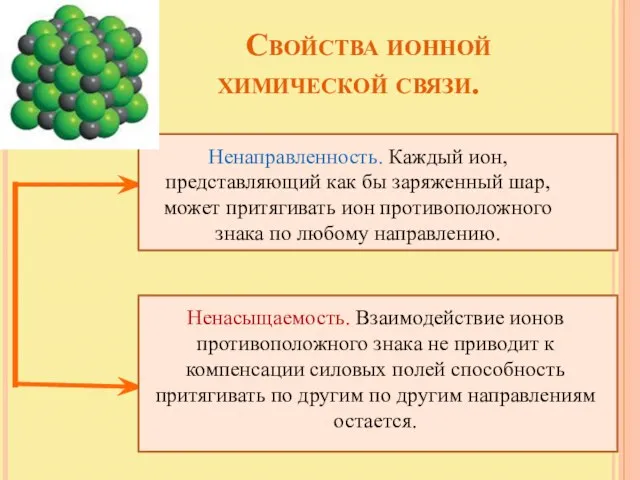
- 14. Свойства ионной химической связи. Ненаправленность. Каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного
- 15. Изображение химической связи.
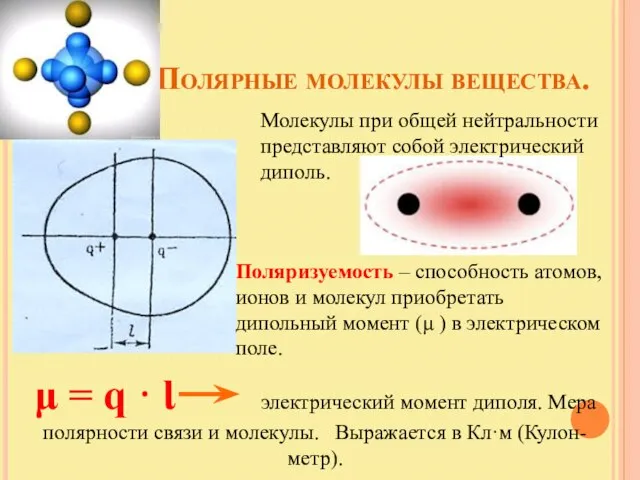
- 16. Полярные молекулы вещества. Молекулы при общей нейтральности представляют собой электрический диполь. Поляризуемость – способность атомов, ионов
- 17. Неполярные молекулы. μ = 0 Молекулы, содержащие неполярную ковалентную связь – электронное облако симметрично по отношению
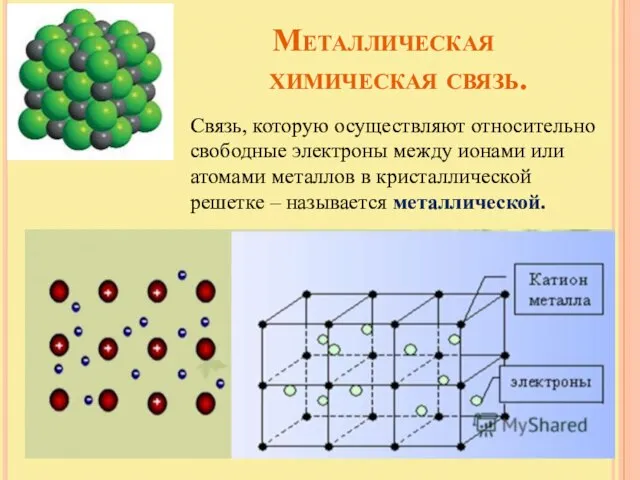
- 18. Металлическая химическая связь. Связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической
- 19. Особенности металлической связи. 1. Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных
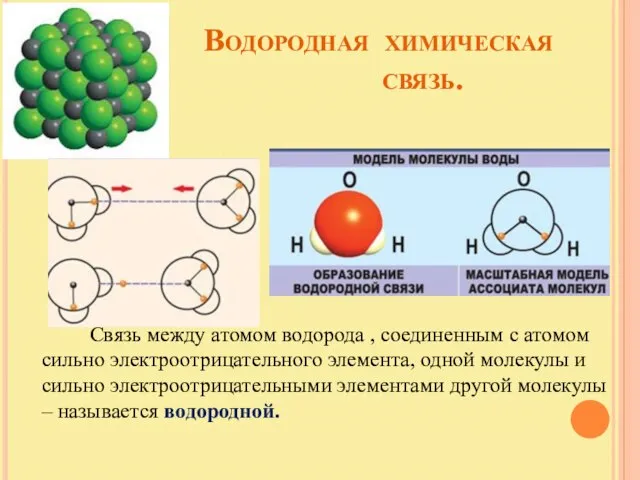
- 20. Водородная химическая связь. Связь между атомом водорода , соединенным с атомом сильно электроотрицательного элемента, одной молекулы
- 21. Особенности водородной химической связи. Связь относится к межмолекулярной; возможно образование внутримолекулярной водородной связи. Водородная связь вторая
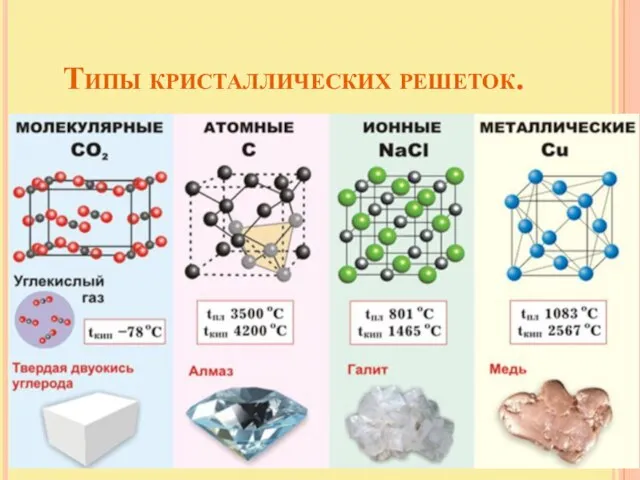
- 22. Типы кристаллических решеток.
- 23. Информация для педагога. Ресурс предназначен для учащихся 11 класса. Является иллюстрацией при освоении темы «Химическая связь».
- 25. Скачать презентацию




 Сульфиты. Сульфаты. Кислотные дожди
Сульфиты. Сульфаты. Кислотные дожди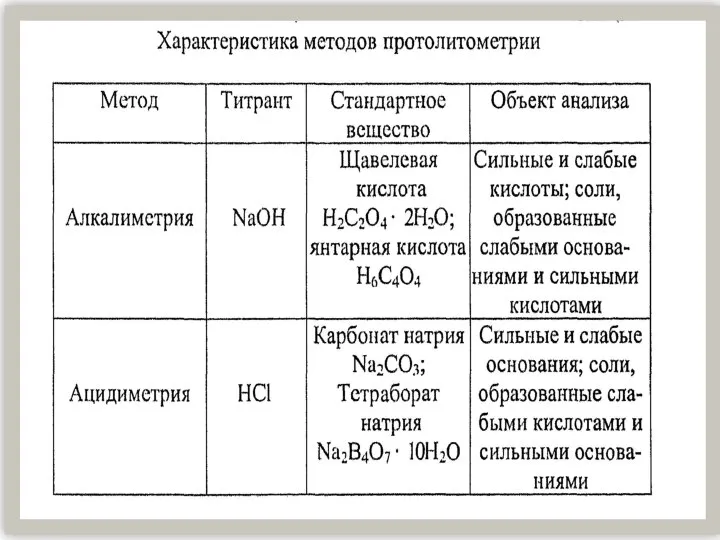 Характеристика методов протолитометрии
Характеристика методов протолитометрии Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Пултаруллă
Пултаруллă Круговорот серы в природе
Круговорот серы в природе Физические свойства неметаллов
Физические свойства неметаллов Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4 Алюминий
Алюминий Основы химической термодинамики
Основы химической термодинамики Строение атома
Строение атома Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп Хлор. Распространение хлора в природе
Хлор. Распространение хлора в природе Строение атома
Строение атома Электролиз
Электролиз Презентация на тему Химия наука о веществах и их превращениях
Презентация на тему Химия наука о веществах и их превращениях  Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Спирты. Методы получения
Спирты. Методы получения Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура Алюминий. 9 класс
Алюминий. 9 класс Сода: мифы и реальность
Сода: мифы и реальность Дисперсные системы. Тест
Дисперсные системы. Тест Комплексные соединения. Аммиакаты
Комплексные соединения. Аммиакаты Основные классы неорганических веществ
Основные классы неорганических веществ Карбоксилденген этоксилаттар
Карбоксилденген этоксилаттар Формула аспирина. Решение задач
Формула аспирина. Решение задач Презентация на тему Великие ученые-химики
Презентация на тему Великие ученые-химики  Химическое расследование. Химические свойства галогенов
Химическое расследование. Химические свойства галогенов