Содержание
- 2. 6.1. Свойства и применение аммиака. Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ
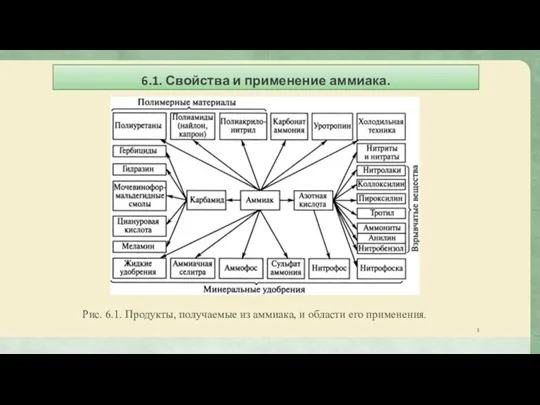
- 3. 6.1. Свойства и применение аммиака. Рис. 6.1. Продукты, получаемые из аммиака, и области его применения.
- 4. 6.2. Физико-химические основы процесса синтеза аммиака. Синтез аммиака осуществляется по уравнению реакции: N2 + 3Н2 ↔
- 5. 6.2. Физико-химические основы процесса синтеза аммиака. Гетерогенно-каталитический процесс синтеза аммиака имеет сложный механизм, который может быть
- 6. 6.2. Физико-химические основы процесса синтеза аммиака. Скорость реакции синтеза аммиака зависит от температуры, давления и состава
- 7. 6.2. Физико-химические основы процесса синтеза аммиака. Реакция синтеза аммиака обратима, поэтому полного превращения азота и водорода
- 8. 6.3. Катализаторы синтеза аммиака. Высокую каталитическую активность в процессе синтеза аммиака проявляют металлы VI, VII и
- 9. 6.4. Технологическое оформление процесса синтеза аммиака. Агрегаты синтеза аммиака в зависимости от применяемого давления можно разделить
- 10. 6.4. Технологическое оформление процесса синтеза аммиака. Рис. 6.2. Принципиальная схема блока синтеза аммиака агрегата мощностью 1360
- 11. 6.4. Технологическое оформление процесса синтеза аммиака. Оборудование агрегата. Технологическая характеристика колонны: Давление, МПа 31,5 Рабочая температура,
- 12. 6.4. Технологическое оформление процесса синтеза аммиака. Оборудование агрегата. Конденсационная колонна — вертикальный цилиндрический аппарат внутренним диаметром
- 14. Скачать презентацию
Слайд 26.1. Свойства и применение аммиака.
Аммиа́к — NH3, нитрид водорода, при нормальных условиях
6.1. Свойства и применение аммиака.
Аммиа́к — NH3, нитрид водорода, при нормальных условиях

Тпл. аммика -77,7 0С; Ткип. -33,350С.
Аммиак — ключевой продукт различных азотсодержащих веществ, применяемых в промышленности и сельском хозяйстве
Слайд 36.1. Свойства и применение аммиака.
Рис. 6.1. Продукты, получаемые из аммиака, и области
6.1. Свойства и применение аммиака.
Рис. 6.1. Продукты, получаемые из аммиака, и области
Слайд 46.2. Физико-химические основы процесса синтеза аммиака.
Синтез аммиака осуществляется по уравнению реакции:
N2 +
6.2. Физико-химические основы процесса синтеза аммиака.
Синтез аммиака осуществляется по уравнению реакции:
N2 +

Реакция обратимая, экзотермическая, характеризуется большим отрицательным энтальпийным эффектом (∆Н298 = -91,96 кДж/моль) и при высоких температурах становится еще более экзотермической (∆H725= -112,86 кДж/моль).
Реакция синтеза аммиака протекает с уменьшением объема. Максимального выхода аммиака можно достичь, проводя процесс при высоком давлении и низких температурах. Синтез аммиака протекает с заметной скоростью только в присутствии катализатора, причем катализаторами данной реакции служат твердые вещества.
Слайд 56.2. Физико-химические основы процесса синтеза аммиака.
Гетерогенно-каталитический процесс синтеза аммиака имеет сложный механизм,
6.2. Физико-химические основы процесса синтеза аммиака.
Гетерогенно-каталитический процесс синтеза аммиака имеет сложный механизм,

диффузия молекул азота и водорода к поверхности катализатора;
хемосорбция молекул реагентов (адсорбатов) на поверхности катализатора;
поверхностная химическая реакция с образованием неустойчивых промежуточных комплексов и взаимодействие между ними;
десорбция продукта;
диффузия продукта реакции (аммиака) от поверхности катализатора в газовую фазу.
Исследование кинетики и механизма реакции синтеза позволило сделать вывод, что лимитирующей стадией процесса является хемосорбция азота.
Слайд 66.2. Физико-химические основы процесса синтеза аммиака.
Скорость реакции синтеза аммиака зависит от температуры,
6.2. Физико-химические основы процесса синтеза аммиака.
Скорость реакции синтеза аммиака зависит от температуры,

Термодинамические и кинетические факторы свидетельствуют в пользу проведения процесса при высоких давлениях (увеличивается равновесный выход, повышается скорость синтеза). Конденсация аммиака также улучшается при высоком давлении. Вместе с тем рост давления увеличивает расход электроэнергии на компрессию, повышает требования к машинам и аппаратам. При понижении давления упрощается аппаратурное оформление процесса, снижается расход энергии, но при этом увеличиваются размеры аппаратов, возрастают энергозатраты на циркуляцию газа и выделение аммиака, повышаются требования к чистоте синтез-газа.
Расчеты показали, что удельные энергоматериальные и капитальные затраты с повышением давления уменьшаются.
На основании проведенного анализа определено, что для современных схем наиболее эффективным является давление приблизительно 30 МПа.
Слайд 76.2. Физико-химические основы процесса синтеза аммиака.
Реакция синтеза аммиака обратима, поэтому полного превращения
6.2. Физико-химические основы процесса синтеза аммиака.
Реакция синтеза аммиака обратима, поэтому полного превращения

Чтобы выделить аммиак, азотоводородную смесь вместе с аммиаком охлаждают до температуры сжижения аммиака. Достичь полной конденсации аммиака не удается. Непрореагировавшая азотоводородная смесь с остаточным аммиаком вновь возвращается на синтез аммиака, при этом в системе будут накапливаться инертные примеси.
Поскольку присутствие инертных примесей в реакционной смеси равносильно снижению общего давления, то с увеличением содержания метана, аргона и гелия в смеси скорость реакции синтеза уменьшается.
Слайд 86.3. Катализаторы синтеза аммиака.
Высокую каталитическую активность в процессе синтеза аммиака проявляют металлы
6.3. Катализаторы синтеза аммиака.
Высокую каталитическую активность в процессе синтеза аммиака проявляют металлы

Катализатор восстанавливают в колонне синтеза аммиака.
Fe3O4 + 4Н2 → 3Fe + 4Н2O, ∆Н > 0.
Катализаторы синтеза аммиака необратимо отравляются сернистыми соединениями и хлором. Их концентрация в газе в сумме не должна превышать 5·10-5% об.
Кислородсодержащие соединения (Н2O, СО, СO2) и кислород, присутствующие в азотоводородной смеси, являются сильными каталитическими ядами, снижающими активность катализатора обратимо. Их отравляющее действие пропорционально содержанию в них кислорода. Если в составе свежего газа имеются кислородсодержащие примеси или масло, газ следует вводить в цикл перед вторичной конденсацией для удаления вредных соединений конденсирующимся аммиаком.
Слайд 96.4. Технологическое оформление процесса синтеза аммиака.
Агрегаты синтеза аммиака в зависимости от применяемого
6.4. Технологическое оформление процесса синтеза аммиака.
Агрегаты синтеза аммиака в зависимости от применяемого

Раньше на установках низкого давления процесс проводили под давлением 10,0 МПа и при низкой температуре (400 °С). Благодаря применению активного катализатора, состоящего из комплексной соли, содержащей цианид железа, получали 8—13% аммиака. В настоящее время схемы синтеза под низким давлением связывают с перспективой снижения энергозатрат, так как одной из главных статей расхода в производстве аммиака является компрессия технологического газа и его рециркуляция. В ряде новых схем синтез аммиака предусматривается вести при том же давлении, что и получение технологического газа (ниже 10 МПа).
Установки высокого давления имели широкое распространение в 30—40-е годы XX в. Процесс вели под давлением 90—100 МПа, что позволяло получить высокую степень превращения азотоводородной смеси в аммиак (40%). Системы высокого давления сейчас не строятся.
В мировой азотной промышленности наибольшее распространение получили установки среднего давления. В России эксплуатируются системы, работающие под давлением 30—36 МПа, а также несколько агрегатов под давлением 45 МПа. Строящиеся системы рассчитаны преимущественно на давление 32 МПа.
В современных агрегатах синтеза аммиака большой единичной мощности процесс ведут на плавленых железных катализаторах при температурах 420—500 oС, давлении 25—32 МПа, объемной скорости 15—25 тыс. ч-1. Съём аммиака с 1 м3 катализатора составляет 20—40 т/сут.
Слайд 106.4. Технологическое оформление процесса синтеза аммиака.
Рис. 6.2. Принципиальная схема блока синтеза аммиака
6.4. Технологическое оформление процесса синтеза аммиака.
Рис. 6.2. Принципиальная схема блока синтеза аммиака
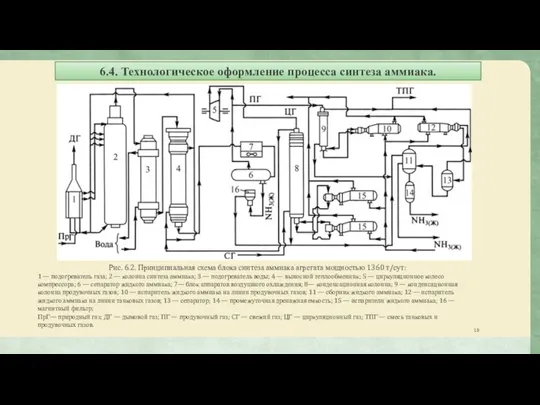
1 — подогреватель газа; 2 — колонна синтеза аммиака; 3 — подогреватель воды; 4 — выносной теплообменник; 5 — циркуляционное колесо компрессора; 6 — сепаратор жидкого аммиака; 7— блок аппаратов воздушного охлаждения; 8— конденсационная колонна; 9 — конденсационная колонна продувочных газов; 10 — испаритель жидкого аммиака на линии продувочных газов; 11 — сборник жидкого аммиака; 12 — испаритель жидкого аммиака на линии танковых газов; 13 — сепаратор; 14 — промежуточная дренажная емкость; 15 — испарители жидкого аммиака; 16 — магнитный фильтр;
ПрГ— природный газ; ДГ — дымовой газ; ПГ — продувочный газ; СГ — свежий газ; ЦГ — циркуляционный газ; ТПГ — смесь танковых и продувочных газов.
Слайд 116.4. Технологическое оформление процесса синтеза аммиака. Оборудование агрегата.
Технологическая характеристика колонны:
Давление, МПа 31,5
Рабочая температура,
6.4. Технологическое оформление процесса синтеза аммиака. Оборудование агрегата.
Технологическая характеристика колонны:
Давление, МПа 31,5
Рабочая температура,

Диаметр (внутренний), мм 2400
Высота, м 32
Толщина стенки, мм 250
Объем катализатора
по полкам I—IV, м3 7; 8,4; 12,8; 14,7
Рис. 6.3. Четырехполочная колонна синтеза аммиака агрегата мощностью 1360 т/сут:
1 — люк для выгрузки катализатора;
2 — центральная труба;
3 — корпус катализаторной коробки;
4 — термопарный чехол;
5 — загрузочный люк;
6 — теплообменник;
7, 9, 11, 13 — вводы байпасного газа;
8, 10, 12, 14— катализаторные слои;
15 — корпус колонны
Слайд 126.4. Технологическое оформление процесса синтеза аммиака. Оборудование агрегата.
Конденсационная колонна — вертикальный цилиндрический
6.4. Технологическое оформление процесса синтеза аммиака. Оборудование агрегата.
Конденсационная колонна — вертикальный цилиндрический

Рис. 6.4. Конденсационная колонна:
1 — корпус;
2 — теплообменник;
3 — отбойник;
4 — сепарационное устройство
 Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты. Сложные эфиры. Жиры Аномальные свойства воды
Аномальные свойства воды Кислоты основания и соли как электролиты
Кислоты основания и соли как электролиты Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Альдегиды. Кетоны
Альдегиды. Кетоны Алкадиены. Физические свойства
Алкадиены. Физические свойства Эвапориты. Химические осадки из ионных растворов
Эвапориты. Химические осадки из ионных растворов Электролитическая диссоциация
Электролитическая диссоциация Химические реакции
Химические реакции Алкины
Алкины Бутан как хладагент
Бутан как хладагент Буферные системы
Буферные системы Определение плотности газообразного вещества по плотности
Определение плотности газообразного вещества по плотности Гидроксиды металлов
Гидроксиды металлов Химия. 8 класс
Химия. 8 класс Конкурс проектных работ Химический элемент … – и это все о нем
Конкурс проектных работ Химический элемент … – и это все о нем Определение площади поверхности и пористости материалов методом сорбции газов
Определение площади поверхности и пористости материалов методом сорбции газов Тема урока: «Свойства тканей из химических волокон»
Тема урока: «Свойства тканей из химических волокон» a319f492a6071afff03d7efc722c906b
a319f492a6071afff03d7efc722c906b Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия
Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия Вещества простые и сложные
Вещества простые и сложные Состав атома
Состав атома Цинк (Zn)
Цинк (Zn) Азот и его соединения
Азот и его соединения Графит (С)
Графит (С) Карбоновые кислоты. Д.И. Менделеев
Карбоновые кислоты. Д.И. Менделеев