Содержание
- 2. Рекомендуемая литература 1. Аналитическая химия. Химические методы анализа. Под ред. О.М.Петрухина. Москва, «Лаборатория знаний», 2017 2.
- 3. Аналитическая химия – это наука о методах и средствах определения качественного и количественного состава веществ и
- 4. Химический анализ - -получение опытным путем данных о химическом составе вещества с использованием методов аналитической химии
- 6. Основные этапы химического анализа
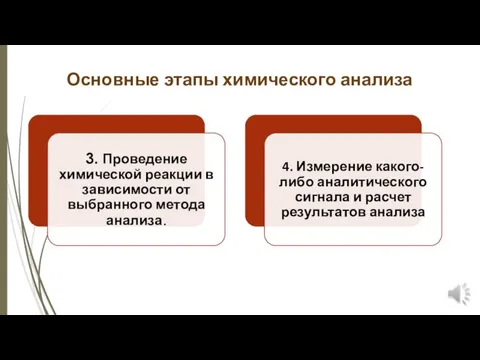
- 7. Основные этапы химического анализа
- 8. Основные этапы химического анализа
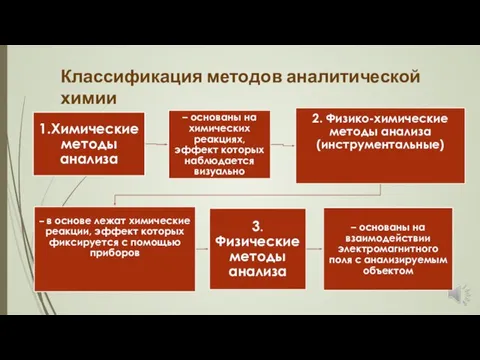
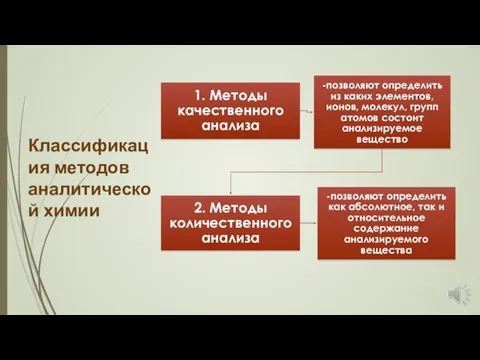
- 9. Классификация методов аналитической химии
- 10. Классификация методов аналитической химии
- 12. Качественный анализ В основе качественного анализа лежат аналитические химические реакции. Это реакции, сопровождающиеся изменением характерных свойств
- 13. Основные аналитические признаки (эффекты) 1.Образование или растворение осадка Pb2+ + 2I- = ↓ PbI2 желтый осадок
- 14. 3. Выделение газа со специфическими свойствами Пример 1 CaCO3 + 2HCl = ↑CO2 + CaCl2 +
- 15. Пример 2 NH4+ + OH- → ↑NH3 + H2O Реакция проводится в «газовой камере». На внутреннюю
- 16. 4. Образование кристаллов строго определенной формы (микрокристаллоскопические реакции) Пример: Ca2+ + SO42- + 2Н2O =↓ CaSO4
- 17. Важнейшие характеристики аналитических химических реакций 1.Чувствительность – это возможность обнаружения данной реакцией минимального количества вещества в
- 18. Относительную чувствительность характеризует предельная концентрация Спред – минимальная концентрация вещества в растворе, при которой реакция дает
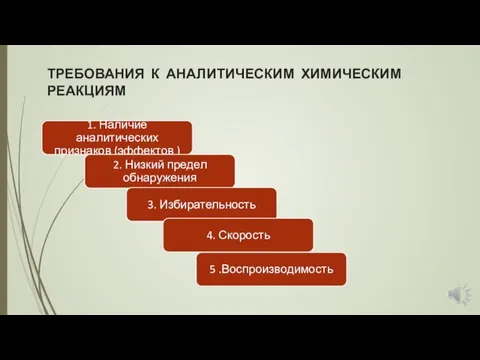
- 19. ТРЕБОВАНИЯ К АНАЛИТИЧЕСКИМ ХИМИЧЕСКИМ РЕАКЦИЯМ
- 20. Условия проведения аналитических химических реакций 1.Достаточные концентрации реагирующих веществ; 2.Обеспечение избирательности реакции; 3.Соблюдение требуемых значений рН
- 22. Скачать презентацию














 Нанотехнологии в быту
Нанотехнологии в быту Избранные главы органической стереохимии
Избранные главы органической стереохимии Нефть и её переработка
Нефть и её переработка 8-9-10 химические формулы
8-9-10 химические формулы Применение кислорода
Применение кислорода Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Супер-химия. Викторина
Супер-химия. Викторина Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40 Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  Галогены
Галогены Галогены. Их значение в жизни человека
Галогены. Их значение в жизни человека Соли
Соли Растворение. Экспериментальная работа с веществами
Растворение. Экспериментальная работа с веществами Разложение отходов. 11 класс
Разложение отходов. 11 класс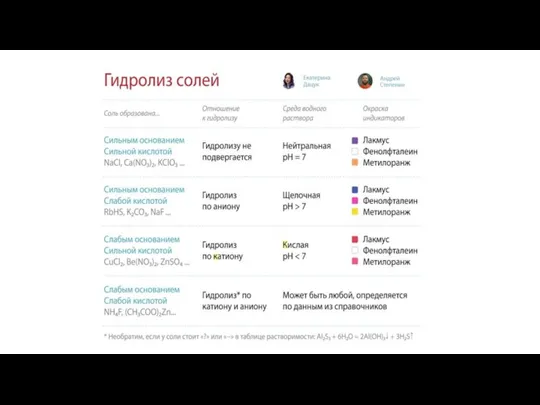 Гидролиз солей
Гидролиз солей Алкилкарбон қышқылдарының тұздарын алу
Алкилкарбон қышқылдарының тұздарын алу Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Фепромарон. Химическое название
Фепромарон. Химическое название Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение Биосинтез фенольных соединений в растениях
Биосинтез фенольных соединений в растениях Презентация на тему Фуллерены и нанотрубки
Презентация на тему Фуллерены и нанотрубки  Ионы. Катионы и анионы
Ионы. Катионы и анионы Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии
Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии Реакция полимеризации
Реакция полимеризации Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс
Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Химия в быту
Химия в быту Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты