Содержание
- 2. Оксиды – сложные вещества, образованные атомами двух элементов, одним из которых является кислород.
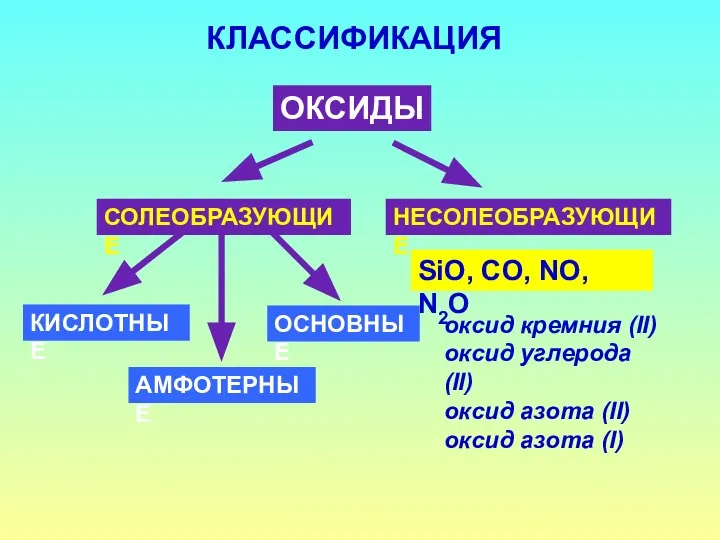
- 3. КЛАССИФИКАЦИЯ ОКСИДЫ СОЛЕОБРАЗУЮЩИЕ НЕСОЛЕОБРАЗУЮЩИЕ SiO, CO, NO, N2O КИСЛОТНЫЕ ОСНОВНЫЕ АМФОТЕРНЫЕ оксид кремния (II) оксид углерода
- 4. КИСЛОТНЫЕ ОКСИДЫ Кислотные оксиды – это такие оксиды, которые реагируют с основаниями с образованием соли и
- 5. КИСЛОТНЫЕ ОКСИДЫ РАСТВОРИМЫЕ НЕРАСТВОРИМЫЕ оксид кремния (IV), диоксид кремния, кремниевый ангидрид, кварцевый песок оксид углерода (IV),
- 6. оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид оксид серы (VI), триоксид серы, серный ангидрид оксид азота
- 7. Оксид фосфора (V) Пентаоксид фосфора Фосфорный ангидрид РО V II 2 5
- 8. Оксид кремния (IV) Диоксид кремния Кремниевый ангидрид SiО IV II 2 Кварцевый песок
- 9. Оксид бора Борный ангидрид ВО III II 2 3
- 10. Оксид хрома (VI) Триоксид хрома Хромовый ангидрид СrО VI II 3
- 11. Оксид азота (IV) Диоксид азота НЕ ангидрид NО IV II 2
- 12. Оксид вольфрама (VI) Триоксид вольфрама Вольфрамовый ангидрид WО VI II 3
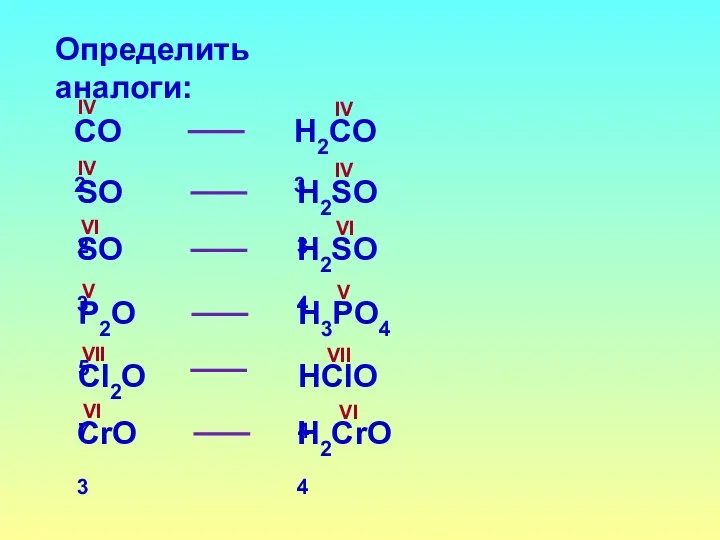
- 13. Определить аналоги: СO2 H2СO3 SO2 H2SO3 SO3 H2SO4 IV IV IV IV VI VI P2O5 H3PO4
- 14. ХИМИЧЕСКИЕ СВОЙСТВА Взаимодействие с водой с образованием кислот. СO2 H2СO2 IV IV + Н2O SO2 H2SO3
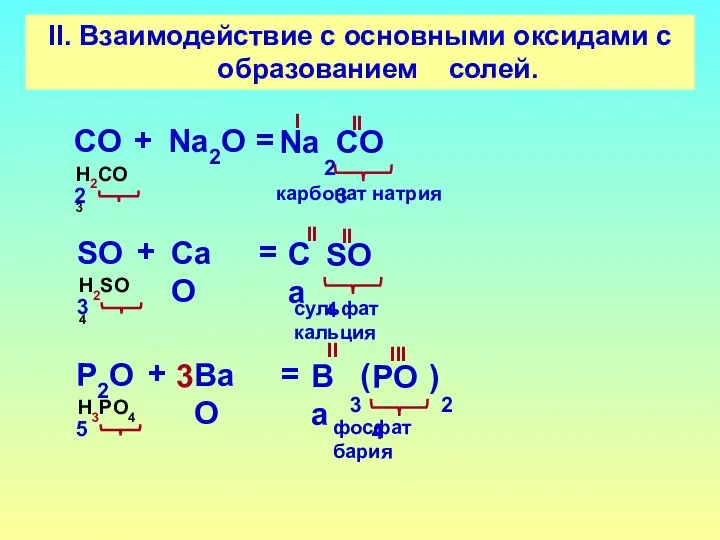
- 15. II. Взаимодействие с основными оксидами с образованием солей. СO2 СO3 + Na2O = H2CO3 II карбонат
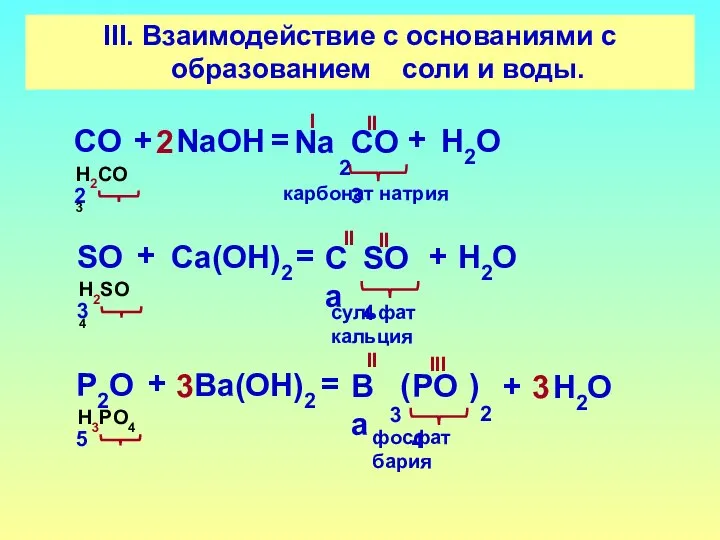
- 16. III. Взаимодействие с основаниями с образованием соли и воды. СO2 СO3 + NaOН = H2CO3 II
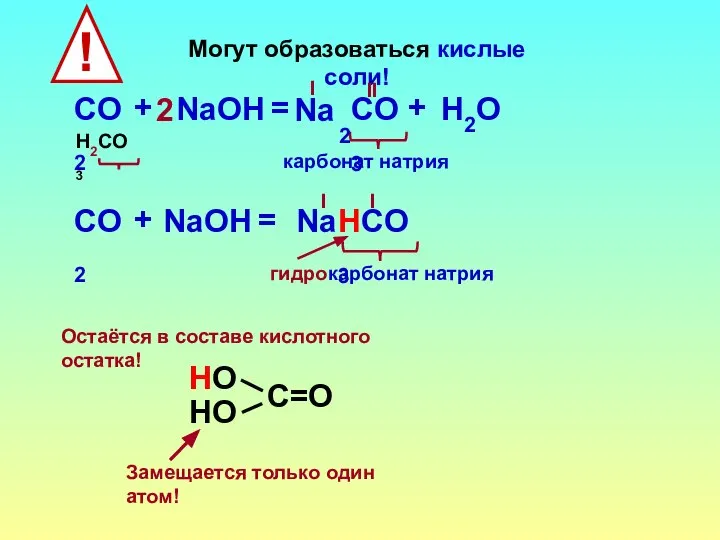
- 17. Могут образоваться кислые соли! СO2 НСO3 + NaOН = I гидрокарбонат натрия Na I Замещается только
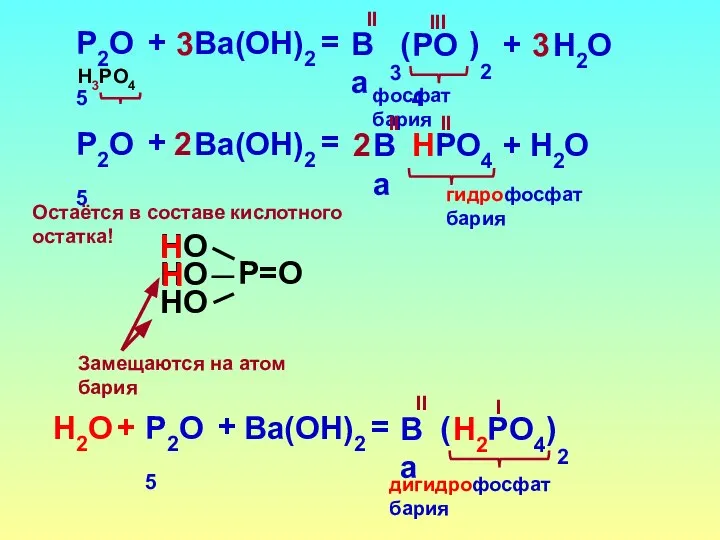
- 18. P2O5 НPO4 + Ba(OН)2 = II гидрофосфат бария Ba 2 II + Н2O 2 Замещаются на
- 19. IV. Индивидуальные свойства. SO2 SO3 + O2 = VI IV 2 2 V2O5, t CO2 CO
- 21. Скачать презентацию












 Electrochemical properties of arylsilanes
Electrochemical properties of arylsilanes Методы защиты металлов от электрохимической коррозии. Классификация методов защиты
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Алканы – строение, химические свойства
Алканы – строение, химические свойства Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Загадки химии
Загадки химии Галогеналканы и реакции отщепления
Галогеналканы и реакции отщепления Алкины. Строение, номенклатура, изометрия, физические свойства
Алкины. Строение, номенклатура, изометрия, физические свойства Азот
Азот Классификация органических соединений
Классификация органических соединений Determination of optical properties of pentacoordinated silicon complexes using DFT method
Determination of optical properties of pentacoordinated silicon complexes using DFT method Степень окисления
Степень окисления Ковалентная связь
Ковалентная связь Нихром. Физические свойства
Нихром. Физические свойства Химические формулы
Химические формулы Экстракция молибдена из азотнокислых растворов карбамоилметилфосфиноксидом, растворенным в высших спиртах
Экстракция молибдена из азотнокислых растворов карбамоилметилфосфиноксидом, растворенным в высших спиртах Углеводы
Углеводы Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3 Каучук
Каучук Электронное строение
Электронное строение Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Процесс диссоциации
Процесс диссоциации Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Амины
Амины Карбон
Карбон Атомы, вещества, молекулы
Атомы, вещества, молекулы Химические уравнения
Химические уравнения