Содержание
- 2. Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций.
- 3. Системы: Гомогенные (однородные) – системы, в которых не видна поверхность раздела между компонентами. Газовые смеси, растворы.
- 4. Реакции: Гомогенные – реакции, протекающие в гомогенных системах. Протекают во всем объеме системы. Гетерогенные– реакции, протекающие
- 5. Скорость химической реакции - изменение концентрации одного из реагирующих веществ за единицу времени в единице объёма.
- 6. Влияние площади соприкосновения реагирующих веществ на скорость реакции. 1. Скорость гетерогенных реакций зависит от площади соприкосновения
- 7. Молярная концентрация – показывает количество молей вещества, находящееся в 1 литре. С = n / V
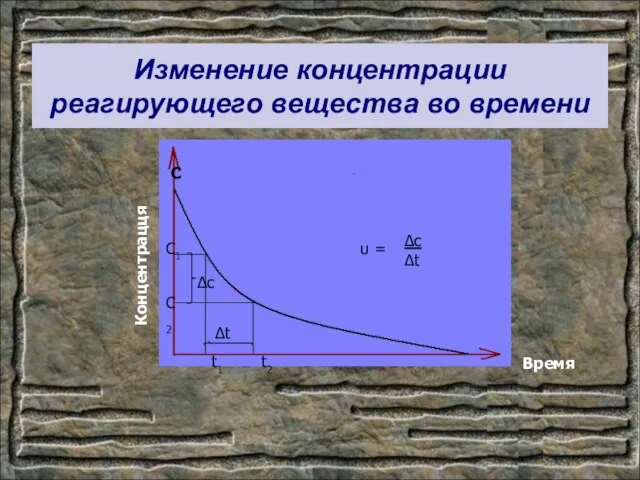
- 8. Изменение концентрации реагирующего вещества во времени С Концентрацця Время С1 С2 t1 t2 ∆c ∆t υ
- 9. Факторы, влияющие на скорость реакции 1. Концентрация реагирующих веществ. 2.Температура. 3. Природа реагирующих веществ. 4. Площадь
- 10. Влияние концентрации реагирующих веществ на скорость реакции. Чем больше концентрация реагирующих веществ, тем чаще сталкиваются частицы
- 11. Закон действия масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степени стехиометрических коэффициентов.
- 12. mА + nB = AmBn υ = k٠САm٠CBn k – константа скорости реакции: k = υ,
- 13. Выражение закона действия масс для реакции: 2СО + О2 = 2СО2 υ = k٠ [СО]2 ∙
- 14. Температура. Правило Вант-Гоффа: при повышении температуры на каждые 100С скорость большинства реакций увеличивается в 2 –
- 15. Влияние температуры на скорость реакции. При повышении температуры, увеличивается скорость движения частиц, поэтому они чаще сталкиваются,
- 16. Влияние природы реагирующих веществ на скорость реакции. 2К+2Н2О=2КОН+Н2↑ 2Н2+О2=2Н2О
- 17. Влияние природы реагирующих веществ на скорость реакции. Са+2Н2О=Са(ОН)2+Н2↑
- 18. Влияние природы реагирующих веществ на скорость реакции. Чем активнее вещество, тем скорость реакции с его участием
- 19. Взаимодействие металлов с кислотами Zn + 2HCl = ZnCl2 + H2↑ υ 1 Fe + 2HCl
- 20. Влияние площади соприкосновения реагирующих веществ на скорость реакции. 1. Скорость гетерогенных реакций зависит от площади соприкосновения
- 21. Влияние площади соприкосновения реагирующих веществ на скорость реакции. Чем больше поверхность соприкосновения веществ, тем больше скорость
- 22. Влияние катализатора на скорость реакции. Катализаторами называются вещества, изменяющие скорость химических реакций. Химические реакции, протекающие при
- 23. Влияние катализатора на скорость реакции. С12Н22О11 + 12О2 = 12СО2+11Н2О
- 25. Скачать презентацию





















 Оксиды. Классификация, химические и физические свойства
Оксиды. Классификация, химические и физические свойства Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия
Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия Презентация на тему Гидролиз
Презентация на тему Гидролиз  Виды лабораторной посуды и её применение в исследовательской работе
Виды лабораторной посуды и её применение в исследовательской работе Органические вещества. 9 класс
Органические вещества. 9 класс Гибридизация АО. Пространственное строение молекул (геометрия молекул)
Гибридизация АО. Пространственное строение молекул (геометрия молекул) Приемы разделения мембранных липидов на классы
Приемы разделения мембранных липидов на классы Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии Перманганатометрия и комплексонометрия
Перманганатометрия и комплексонометрия Изомерия. Виды изомерии
Изомерия. Виды изомерии Классы неорганических веществ. Типы химических реакций Конкурс знаний
Классы неорганических веществ. Типы химических реакций Конкурс знаний Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Неорганические вещества
Неорганические вещества Методы диагностики плазмы
Методы диагностики плазмы Практическая работа: наблюдение роста кристалов
Практическая работа: наблюдение роста кристалов Реакции разложения и соединения
Реакции разложения и соединения Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Агрегатные состояния вещества
Агрегатные состояния вещества Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс
Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот Изготовление слайма в домашних условиях
Изготовление слайма в домашних условиях Химия в быту
Химия в быту АЛЬДЕГИДЫ И КЕТОНЫ
АЛЬДЕГИДЫ И КЕТОНЫ _ _Производство цветных металлов. Методы плавки алюминия_
_ _Производство цветных металлов. Методы плавки алюминия_ Развитие познавательной активности творческих способностей и индивидуализация на уроках химии
Развитие познавательной активности творческих способностей и индивидуализация на уроках химии