Содержание
- 2. «Загадка»: Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет
- 3. Тема урока: Железо. Железо не только основа всего мира, самый главный металл окружающей нас природы, оно
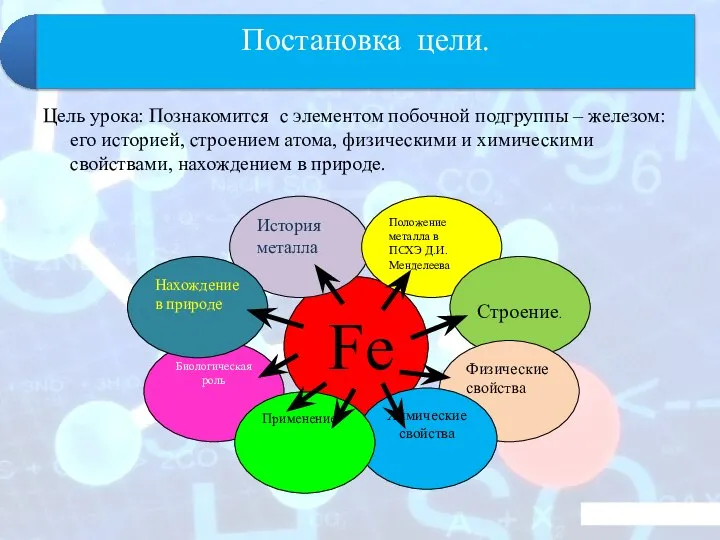
- 4. Цель урока: Познакомится с элементом побочной подгруппы – железом: его историей, строением атома, физическими и химическими
- 5. Положение металла в ПСХЭ. Строение. Работая в паре, определите местоположение элемента в Периодической системе, составьте электронную
- 6. 4 период VIII группа побочная подгруппа +26Fe 2ē , 8ē , 14ē , 2ē Характерные степени
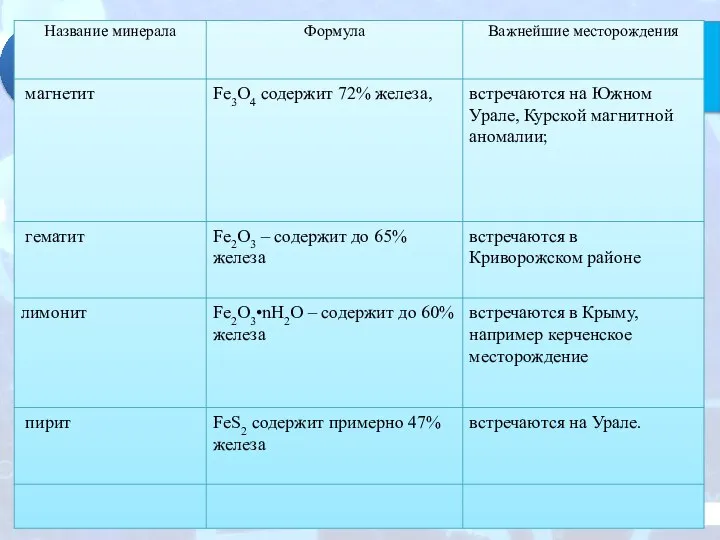
- 7. Задание: 1. Назвать важнейшие руды и минералы, содержащие железо. Для работы воспользуйтесь физической картой 2. Показать
- 8. Физические свойства - серебристо-белый металл, быстро тускнеющий (ржавеющий) на влажном воздухе или в воде, содержащей кислород;
- 9. Задание: определить и доказать физические свойства железа: Оборудование: гвоздь с ниткой, стакан на 100 мл. с
- 10. Получение железа 1. Алюминотермия. Fe2O3 + 2 AI = AI2O3 + 2 Fe 2. Прямое восстановление
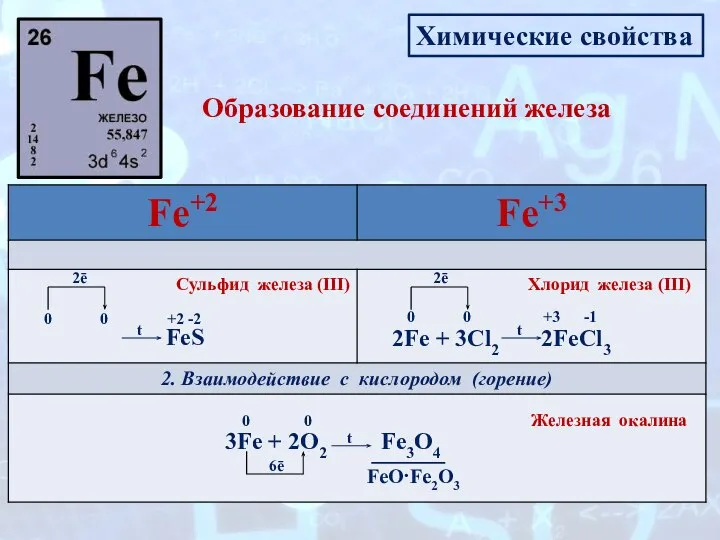
- 11. Химические свойства Образование соединений железа 1. Взаимодействие с неметаллами Fe + S 0 0 2ē t
- 12. Химические свойства Образование соединений железа 3Fe + 4H2O Fe3O4 + 4H2↑ +1 0 -2 +2 +3
- 13. Химические свойства Образование соединений железа Fe + 2HCl → FeCl2 + H2↑ 0 +1 0 -1
- 14. Подведем итог: Химические свойства: 1. Взаимодействие с простыми веществами - неметаллами. Fe + S= FeS (при
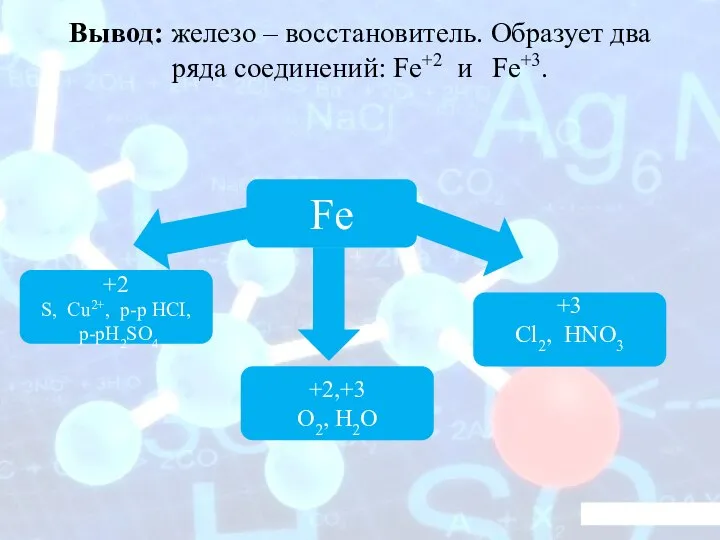
- 15. Вывод: железо – восстановитель. Образует два ряда соединений: Fe+2 и Fe+3. Fe +3 Cl2, HNO3 +2
- 16. 6. Биологическая роль железа. Задание: прочитайте текст, заполните таблицу. Какова роль железа в жизни человека и
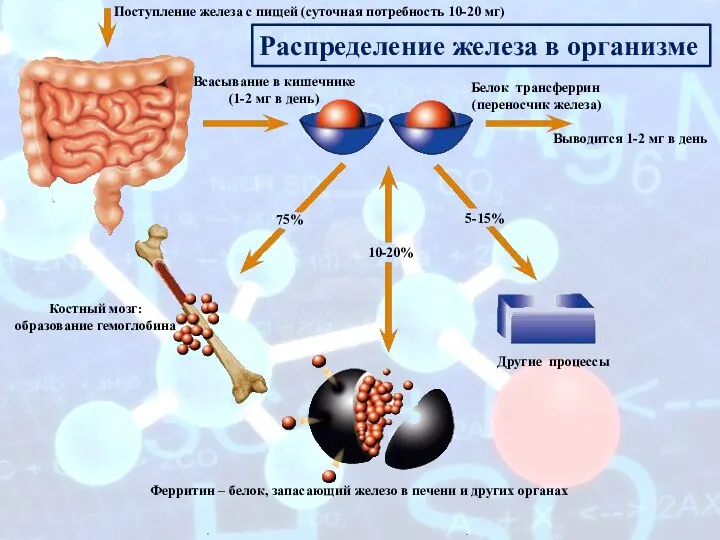
- 17. Поступление железа с пищей (суточная потребность 10-20 мг) Всасывание в кишечнике (1-2 мг в день) Белок
- 18. Задание: воспользуйтесь информационными ресурсами и укажите области применения железа и его сплавов. Составьте схему: Fe
- 19. Железо ржавеет, не находя себе применения, стоячая вода гниет или на холоде замерзает, а ум человека,
- 21. Ошибка Ошибка Ошибка Ошибка Железо легко куется. Железо взаимодействует с концентрированными кислотами H2SO4 и HNO3. Железо
- 22. Вернемся к теме сегодняшнего урока. Какие цели мы поставили в начале его? Удалось ли нам их
- 24. Скачать презентацию















 Полистирол. Оформление мини-реферата по химии
Полистирол. Оформление мини-реферата по химии Природные смолы: мирра, ладан и шеллак
Природные смолы: мирра, ладан и шеллак ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Prezentatsia_lektsia_Reaktora_2_Materialny_balans
Prezentatsia_lektsia_Reaktora_2_Materialny_balans Презентация по Химии "Группа веществ, не требующих особых методов изолирования"
Презентация по Химии "Группа веществ, не требующих особых методов изолирования"  Метелёва И.Е. учитель химии
Метелёва И.Е. учитель химии Галогены
Галогены Вебинар. Гидролиз солей
Вебинар. Гидролиз солей Ионные уравнения реакций
Ионные уравнения реакций Неньютоновская жидкость
Неньютоновская жидкость Побочная подгруппа VIII группы
Побочная подгруппа VIII группы Строение атома
Строение атома Подготовка к ЕГЭ по химии
Подготовка к ЕГЭ по химии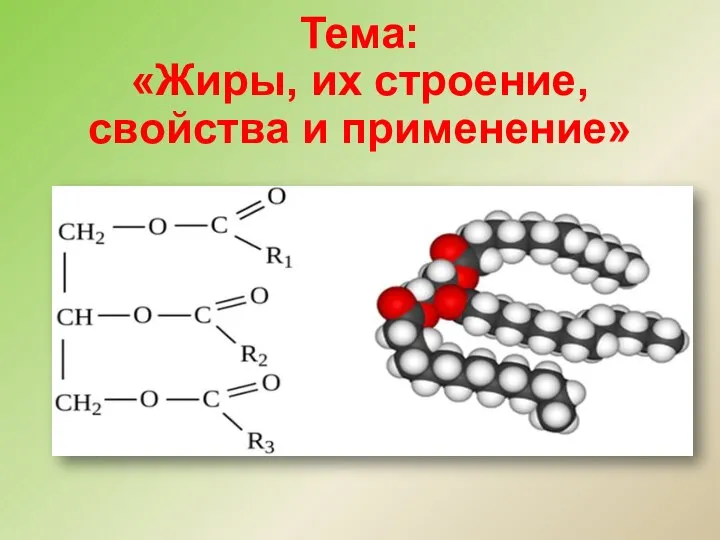 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Соли. Формула соли
Соли. Формула соли Соединения щелочных металлов
Соединения щелочных металлов Алканы. Строение
Алканы. Строение Комплексные соли. 11 класс
Комплексные соли. 11 класс Презентация на тему Уксусная кислота
Презентация на тему Уксусная кислота  Минерал Александрит
Минерал Александрит Кислоты. Состав кислот, их классификация и физические свойства, 8 класс
Кислоты. Состав кислот, их классификация и физические свойства, 8 класс День химии
День химии Свойства воды
Свойства воды Строение вещества. Молекулы
Строение вещества. Молекулы Методика изготовления сенсора
Методика изготовления сенсора Спирты и их производные. Применение метанола и этанола
Спирты и их производные. Применение метанола и этанола Спирты
Спирты Константы диссоциации и PH
Константы диссоциации и PH