от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой
Содержание
- 2. Цель урока. Сформировать у учащихся понятие гидролиза солей. Задачи обучения. Сформировать понятие “Гидролиз”, Расширить знания о
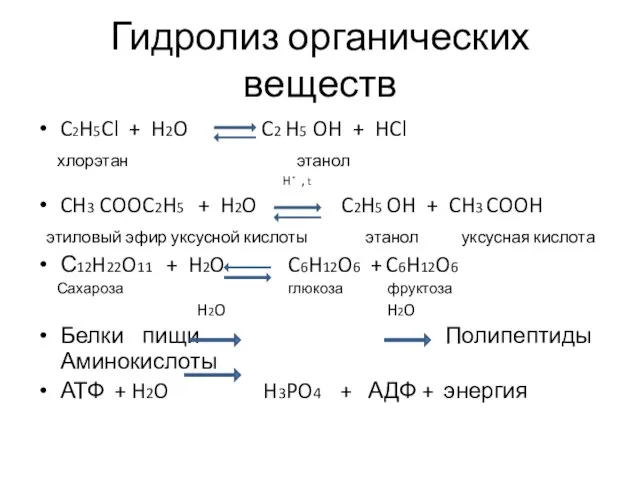
- 3. Гидролиз органических веществ C2H5Cl + H2O C2 H5 OH + HCl хлорэтан этанол H⁺ , t
- 4. Гидролиз бинарных соединений Карбиды металлов: CaC2 + 2H2O Ca(OH)2 +C2H2 Al4C3 + 12H2O 4Al(OH)3 +3CH4 Галогениды
- 5. Гидролиз солей Водные растворы солей имеют разные значения pH и различные типы сред – кислую (pH
- 6. 4 типа солей.
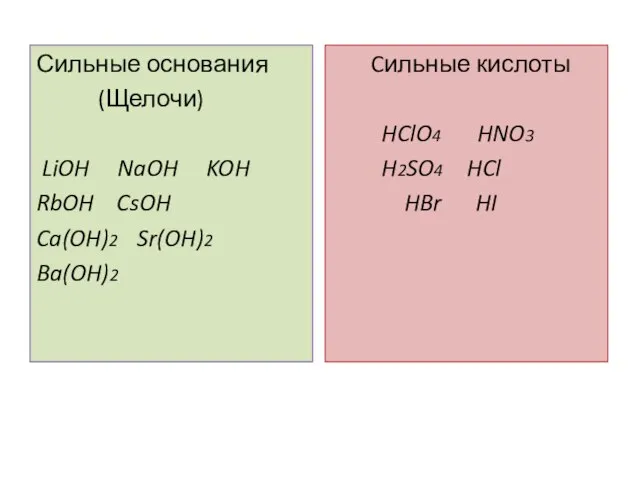
- 7. Сильные основания (Щелочи) LiOH NaOH KOH RbOH CsOH Ca(OH)2 Sr(OH)2 Ba(OH)2 Cильные кислоты HClO4 HNO3 H2SO4
- 8. Гидролиз по аниону (соль образована сильным основанием и слабой кислотой) KNO2 = K⁺ + NO2¯ NO2¯
- 9. Гидролиз по катиону (соль образована слабым основанием и сильной кислотой) Ni(NO3)2 = Ni²⁺ + 2 NO3¯
- 10. Необратимый гидролиз (соли образованы слабым основанием и слабой кислотой) Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
- 11. Изменение направления гидролиза Усиление Добавить воды; Нагреть раствор; Связать один из продуктов гидролиза в труднорастворимое соединение
- 12. Применение гидролиза Основной компонент мыла – это натриевые или калиевые соли высших жирных кислот: стеараты, пальмитаты,
- 13. Контрольный тест 1. Гидролиз солей – это взаимодействие с водой а) катионов или анионов любой (по
- 14. 3. Соль, гидролизуемая по аниону, - это а) Rb2CO3 б) RbCl в) AgCl г) CaCO3 4.
- 15. 7. В растворе соли по катиону химическая среда а) щелочная б) кислая в) нейтральная г) может
- 16. Подведение итогов. Итак, сегодня мы познакомились с явлением гидролиза солей. Прошу дать краткие ответы на мои
- 17. Рефлексивный тест. Я узнал (а) много нового. Мне это пригодится в жизни. На уроке было над
- 19. Скачать презентацию














 Vvedenie_v_khimiyu
Vvedenie_v_khimiyu Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите
Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите Ar, Mr
Ar, Mr Три службы Менделеева для России
Три службы Менделеева для России Химическая школа ДПИ НГТУ
Химическая школа ДПИ НГТУ Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина Жиры – биологически важные органические соединения
Жиры – биологически важные органические соединения Технология переработки редкоземельного сырья
Технология переработки редкоземельного сырья Кислород
Кислород Белки
Белки Полиморфизм и метастабильные состояния в однокомпонентных системах
Полиморфизм и метастабильные состояния в однокомпонентных системах Основы неорганической химии
Основы неорганической химии Новое в ЕГЭ. Химия
Новое в ЕГЭ. Химия Химия вокруг нас
Химия вокруг нас Вода - растворитель
Вода - растворитель Презентация на тему Алюминий и его соединения
Презентация на тему Алюминий и его соединения  Презентация на тему Химические синонимы
Презентация на тему Химические синонимы  Классификация кислот
Классификация кислот Золото. Золотые сплавы
Золото. Золотые сплавы Использование ИКТ в преподавании химии. Современный урок
Использование ИКТ в преподавании химии. Современный урок Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна
Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов
Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов Повторение по химии (8 класс)
Повторение по химии (8 класс) Полезные ископаемые
Полезные ископаемые Фиды специфичности ферментов. Субстратная специфичность
Фиды специфичности ферментов. Субстратная специфичность Классификация реакций в органической химии
Классификация реакций в органической химии Атом
Атом