Слайд 32. Теоретический радел
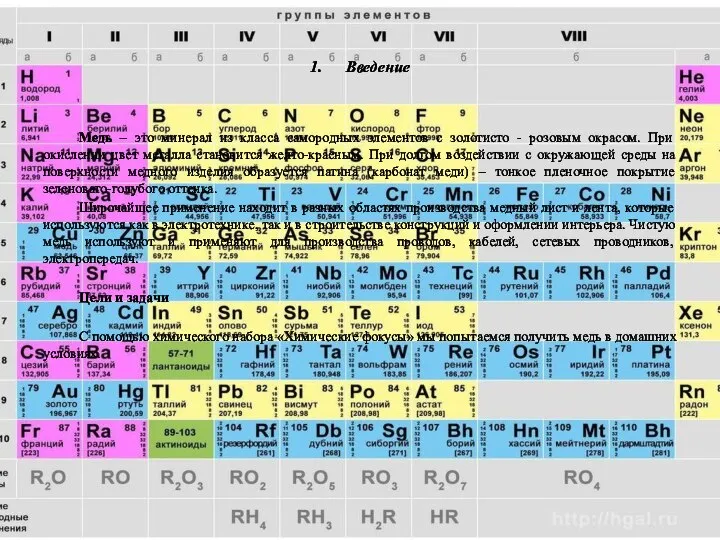
Медь можно встретить намного чаще, чем иные металлы, например: железо,

серебро или золото. Так же медь входит в семёрку металлов, узнаваемых человеку еще со старых времён. Из-за собственной доступности и низкой температуре при плавлении, и легкой пластичности, медь с давних времен применяется человеком почти во всех видах деятельности. К примеру, при соединении меди с оловом получается сплав, который называется - бронзой.
В период бронзового столетия из этого метала, выплавляли орудия, ювелирные украшения и столовые приборы. Бронза отличается высочайшей прочностью и неплохой ковкостью. Промышленная выплавка меди была освоена еще в 8 столетие, но только в 15 столетие она достигла универсальности и совершенства. С помощью бронзы стали выплавлять колокола, благовидные статуи. Из-за невысокого удельного сопротивления, медь очень часто применяют в электронике для производства электрических кабелей и проводов.
Медный кабель, часто используют в обмотках для электроприборов и электросиловых трансформаторов, еще одним полезным свойством меди является высокая теплопроводимость. Это позволяет использовать медь в разных теплоотводных устройствах, теплообменниках, к которым относятся такие устройства как: кондиционеры, секционные радиаторы для отопления.
Вследствие легкоплавкости этот металл издавна имеет огромное значение, как в чистом виде, так и в разных соединениях. К примеру, в ювелирном искусстве для прочности украшений, этот металл соединяют с золотом. А соединение меди с цинком, алюминием очень часто используют в автомобилестроении, кораблестроении и даже в ракетостроении.









 Азотсодержащие. Амины (семинар)
Азотсодержащие. Амины (семинар) Свободные атомы. Простые вещества. Сложные вещества
Свободные атомы. Простые вещества. Сложные вещества Атомы, вещества, молекулы
Атомы, вещества, молекулы Теоретические основы метода потенциалов самопроизвольной поляризации - ПС
Теоретические основы метода потенциалов самопроизвольной поляризации - ПС Адсорбция на границе раствор-газ. ПАВ и ПНАВ
Адсорбция на границе раствор-газ. ПАВ и ПНАВ Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню
Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Химический тренажер
Химический тренажер Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ
Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ Общая характеристика металлов
Общая характеристика металлов Материалы в промышленности
Материалы в промышленности Применение углерода
Применение углерода Вебинар. Гидролиз солей
Вебинар. Гидролиз солей Алкены
Алкены Строение вещества
Строение вещества Дисперсные системы
Дисперсные системы Драгоценные камни
Драгоценные камни Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Производство аммиака
Производство аммиака Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Кислоты. Классификация. Номенклатура
Кислоты. Классификация. Номенклатура Классификация органических реакций, реагентов
Классификация органических реакций, реагентов Сера
Сера Строение органических веществ
Строение органических веществ Неметаллы
Неметаллы Галогены. Обобщение знаний
Галогены. Обобщение знаний