Содержание
- 2. * Знаки химических элементов. - название - произношение Al Ba Ca Na K Cl S F
- 3. Имеют ли вес атомы и как его измерить? Джон Дальтон (1766-1844) английский физик и химик ,
- 4. Массы атомов ничтожно малы Масса самого лёгкого атома водорода 0,000 000 000 000 000 000 000
- 5. Абсолютная и относительная масса Иногда используются не абсолютные, а относительные величины ; например, диетологи , чтобы
- 6. Эталон для сравнения атомных масс Учёные пытались сопоставить во сколько раз массы атомов одних элементов тяжелее
- 7. Атомная единица массы m(1 а.е.м.)=0,00000000000000000000000000166кг=1,66 ×10 -27кг ma(H)=1 а.е.м. ma(He)=4 а.е.м.
- 8. Относительная атомная масса -Аr Аr показывает во сколько раз масса атома элемента больше 1/12 части массы
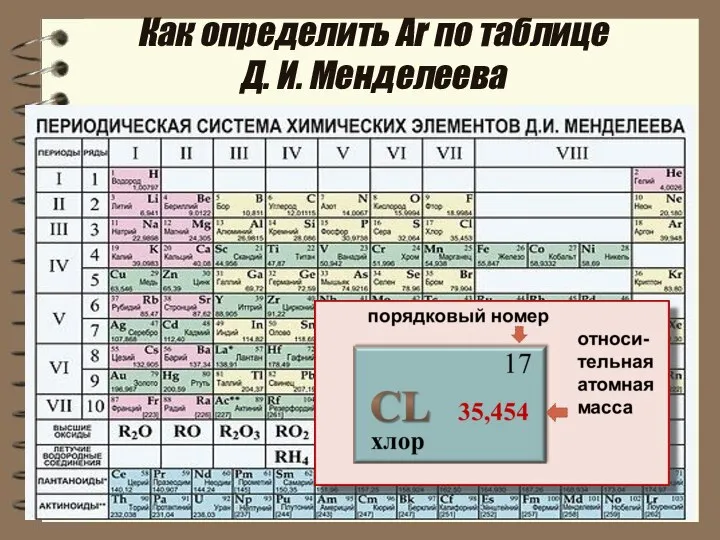
- 9. Как определить Аr по таблице Д. И. Менделеева
- 10. Значения относительных атомных масс некоторых химических элементов водород 1 1,00797 кислород углерод 15,9994 12,01115 8 6
- 11. Дробное значение Аr хлор 17 35,454 В расчётах используют значения относительных атомных масс , округлённые до
- 12. Что означают записи: ma(Al)=27 a.e.м. ma(S)=32 a.e.м. Аr(Al)=26,9815≈27 Ar(S)=32,064≈32 Напишите округлённые значения относительных атомных масс элементов
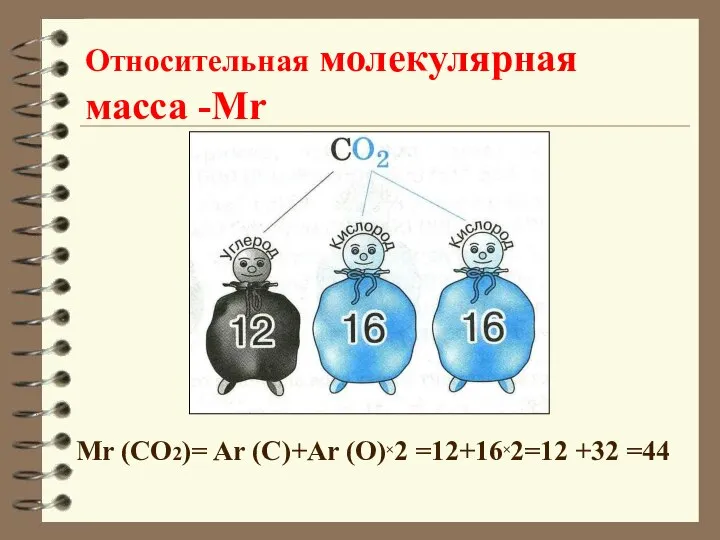
- 13. Относительная молекулярная масса -Мr показывает во сколько раз масса молекулы вещества больше 1/12 массы атома углерода
- 14. Относительная молекулярная масса -Мr Mr (CO2)= Ar (C)+Ar (O)×2 =12+16×2=12 +32 =44
- 15. Рассчитайте Мr (H2) = Mr (СаСl2) = Mr (CaCO3) = Мr (Ca(OH)2)= Mr (СН3СООН)= Мr (Ca3(PO4)2)=
- 16. Химический диктант I вариант Мr(SO3) = Mr(NO2) = Mr(Al2S3) = Mr(Cl2) = Mr(K 2CO3) = Mr(Al(OH)3)
- 17. IV. Массовая доля элемента в веществе. * I. Массовая доля - w w(Э) = n Ar(Э)
- 19. Скачать презентацию














 Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Хлор
Хлор 4 Минеральные удобрения (1)
4 Минеральные удобрения (1) Глюконеогенез. Суммарное уравнение реакций глюконеогенеза
Глюконеогенез. Суммарное уравнение реакций глюконеогенеза СПИРТЫ, ФЕНОЛЫ
СПИРТЫ, ФЕНОЛЫ Её величество – вода Интегрированный урок химии в 8 классе
Её величество – вода Интегрированный урок химии в 8 классе Массовая доля элемента в веществе
Массовая доля элемента в веществе Строение молекул. Метод валентных связей. Лекция 5
Строение молекул. Метод валентных связей. Лекция 5 Синтез латексов
Синтез латексов Неорганические и органические кислоты
Неорганические и органические кислоты Аминоксилоты. Общая формула аминокислот
Аминоксилоты. Общая формула аминокислот Структура периодической таблицы элементов
Структура периодической таблицы элементов Электролиз
Электролиз Классификация веществ
Классификация веществ АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ
АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ Органическая химия. Теория строения органических соединений
Органическая химия. Теория строения органических соединений Атомы химических элементов
Атомы химических элементов Галогениды. Лекция 11
Галогениды. Лекция 11 Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра Скорость химических реакций
Скорость химических реакций Процесс образования неметаллических включений в стали
Процесс образования неметаллических включений в стали Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем Коррозия металла
Коррозия металла Классификация реагентов и реакции в органической химии
Классификация реагентов и реакции в органической химии Хроматография. Особенности метода хроматографии
Хроматография. Особенности метода хроматографии Презентация на тему Элементы таблицы Менделеева
Презентация на тему Элементы таблицы Менделеева  Удивительные свойства латекса и его применение
Удивительные свойства латекса и его применение Презентация на тему Серная кислота
Презентация на тему Серная кислота