Содержание
- 2. ОГЛАВЛЕНИЕ: 1. Гомологический ряд, номенклатура 2. Классификация 3. Строение. Изомерия 4. Реакционноспособность 5. Химические свойства 6.
- 3. ГОМОЛОГИЧЕСКИЙ РЯД Спирты-продукты замещения в углеводородах водородных атомов на группы –ОН (гидроксильную) , связанную с sp3
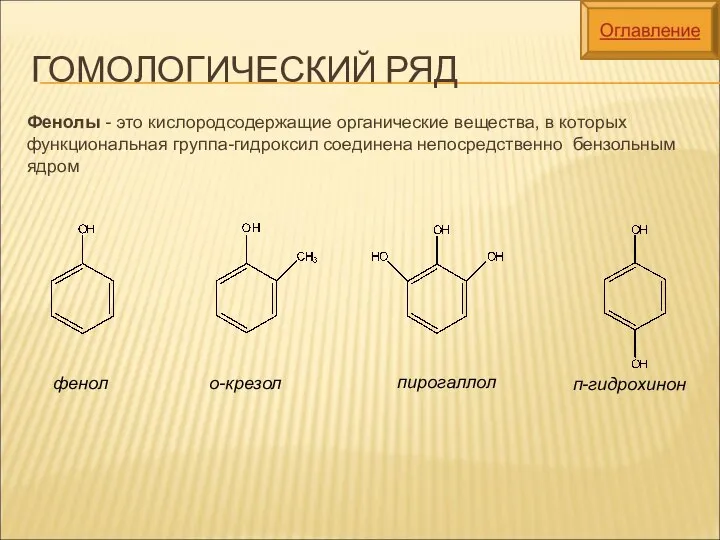
- 4. ГОМОЛОГИЧЕСКИЙ РЯД Фенолы - это кислородсодержащие органические вещества, в которых функциональная группа-гидроксил соединена непосредственно бензольным ядром
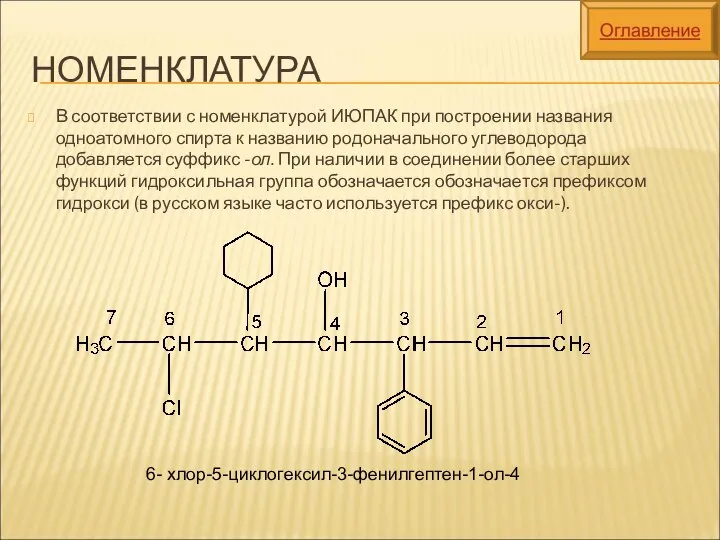
- 5. НОМЕНКЛАТУРА В соответствии с номенклатурой ИЮПАК при построении названия одноатомного спирта к названию родоначального углеводорода добавляется
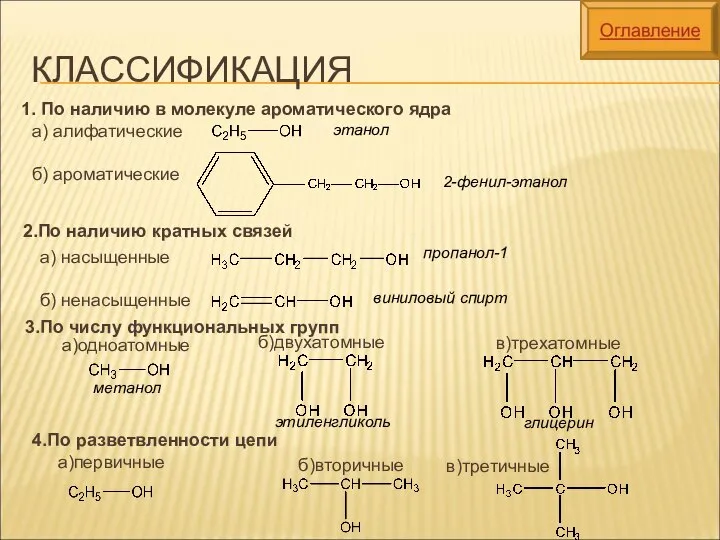
- 6. КЛАССИФИКАЦИЯ 1. По наличию в молекуле ароматического ядра 2.По наличию кратных связей 3.По числу функциональных групп
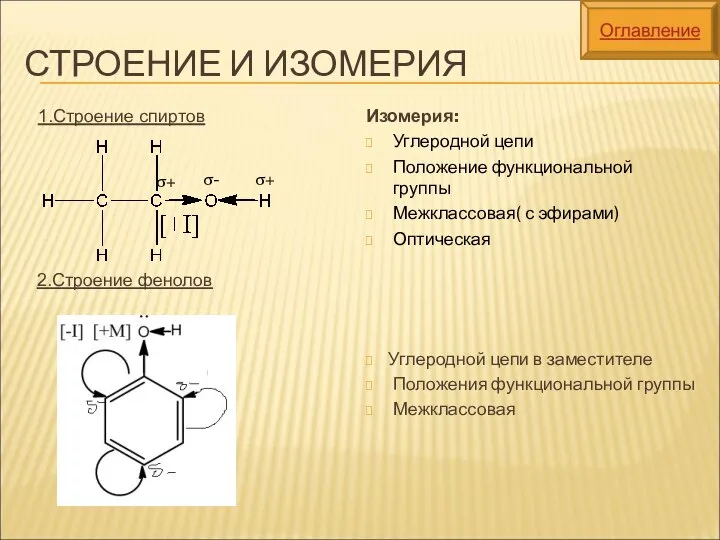
- 7. СТРОЕНИЕ И ИЗОМЕРИЯ Изомерия: Углеродной цепи Положение функциональной группы Межклассовая( с эфирами) Оптическая Углеродной цепи в
- 8. РЕАКЦИОННОСПОСОБНОСТЬ Спиртов(одноатомных) Тип реакций -замещение, отщепление Механизм реакций- нуклеофильный , по «кислому»водороду Реакционный центр заряжен положительно.
- 9. РЕАККЦИОННОСПОСОБНОСТЬ Спиртов(многоатомных) Тип реакций- замещение Механизм- нуклеофильный Реакционный центр заряжен положительно, вещество предельное Возможны реакции по
- 10. РЕАКЦИОННОСПОСОБНОСТЬ Фенолов Тип реакции – замещение Механизм реакции-электрофильный Функциональная группа обладает │-J│и│+M│ , поскольку мезомерный эффект
- 11. ХИМИЧЕСКИЕ СВОЙСТВА ОДНОАТОМНЫХ СПИРТОВ 1. Окисление А) полное Б) неполное: качественная реакция на одноатомные спирты 2.Реакция
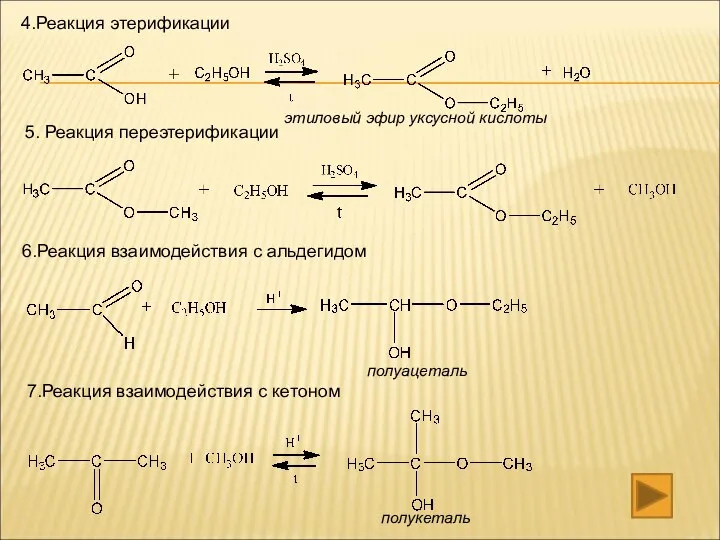
- 12. 4.Реакция этерификации 5. Реакция переэтерификации 6.Реакция взаимодействия с альдегидом 7.Реакция взаимодействия с кетоном этиловый эфир уксусной
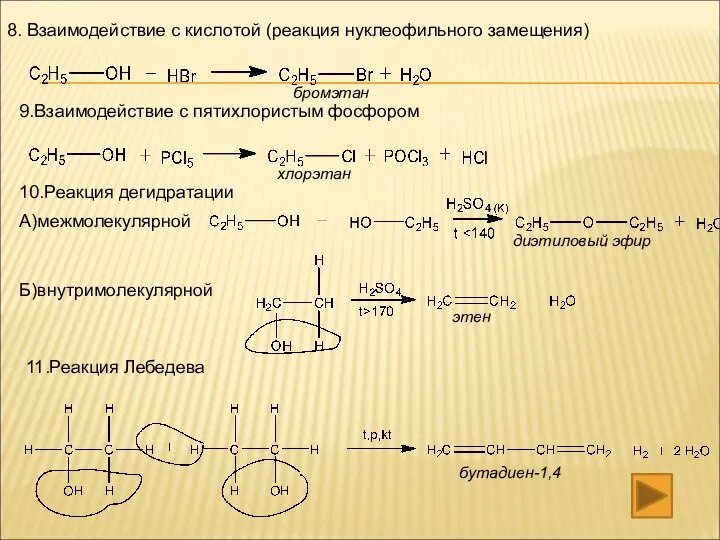
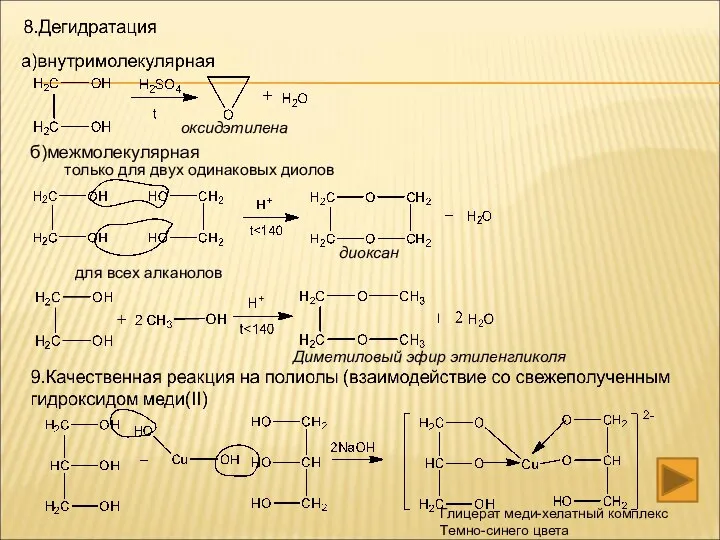
- 13. 8. Взаимодействие с кислотой (реакция нуклеофильного замещения) 9.Взаимодействие с пятихлористым фосфором 10.Реакция дегидратации А)межмолекулярной Б)внутримолекулярной 11.Реакция
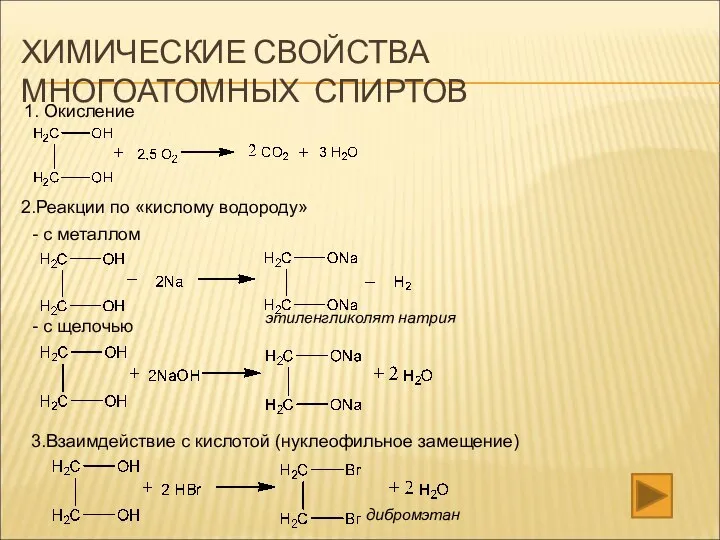
- 14. ХИМИЧЕСКИЕ СВОЙСТВА МНОГОАТОМНЫХ СПИРТОВ 1. Окисление 2.Реакции по «кислому водороду» - с металлом - с щелочью
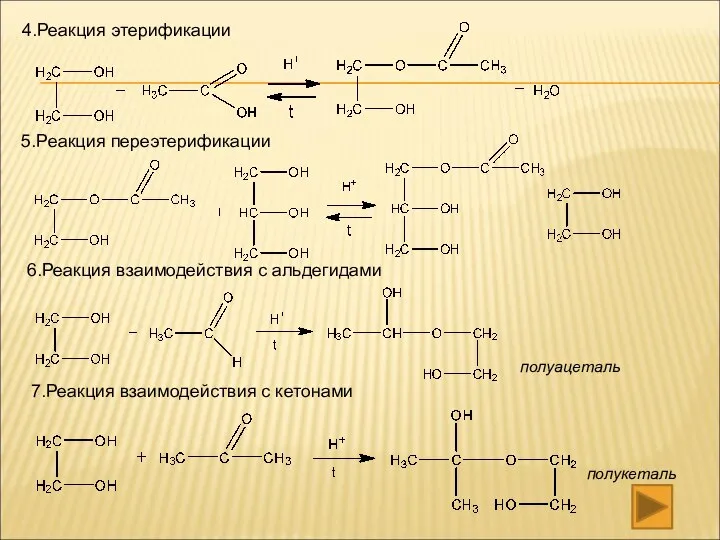
- 15. 4.Реакция этерификации 5.Реакция переэтерификации 6.Реакция взаимодействия с альдегидами 7.Реакция взаимодействия с кетонами полуацеталь полукеталь
- 16. б)межмолекулярная только для двух одинаковых диолов для всех алканолов оксидэтилена диоксан Диметиловый эфир этиленгликоля Глицерат меди-хелатный
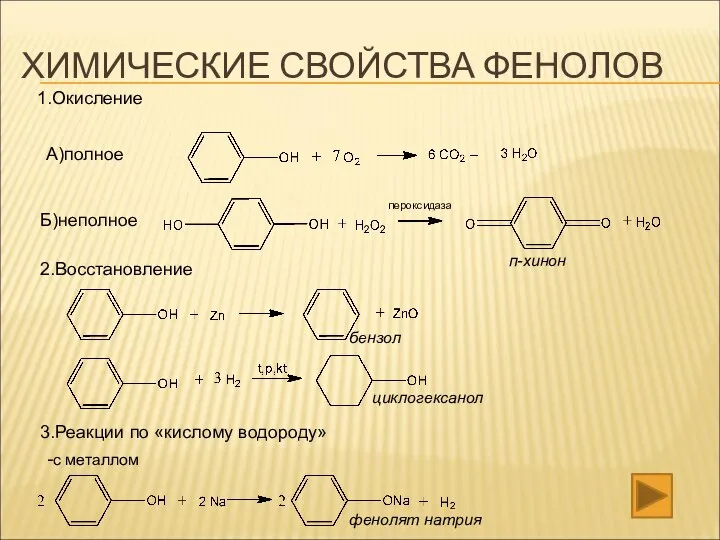
- 17. ХИМИЧЕСКИЕ СВОЙСТВА ФЕНОЛОВ 1.Окисление А)полное Б)неполное 2.Восстановление 3.Реакции по «кислому водороду» -с металлом п-хинон бензол циклогексанол
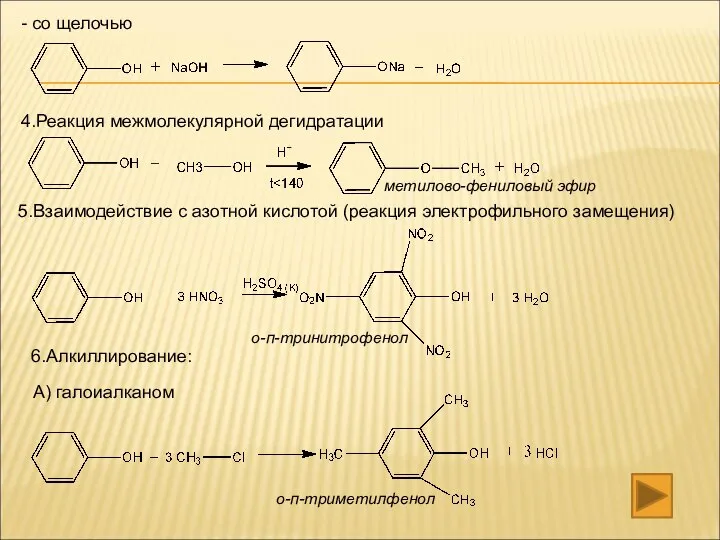
- 18. 4.Реакция межмолекулярной дегидратации 5.Взаимодействие с азотной кислотой (реакция электрофильного замещения) 6.Алкиллирование: А) галоиалканом - со щелочью
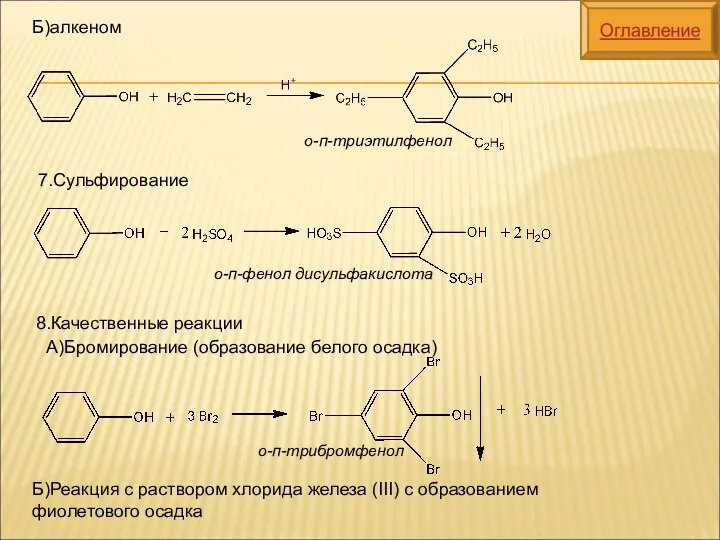
- 19. 8.Качественные реакции Б)Реакция с раствором хлорида железа (III) с образованием фиолетового осадка А)Бромирование (образование белого осадка)
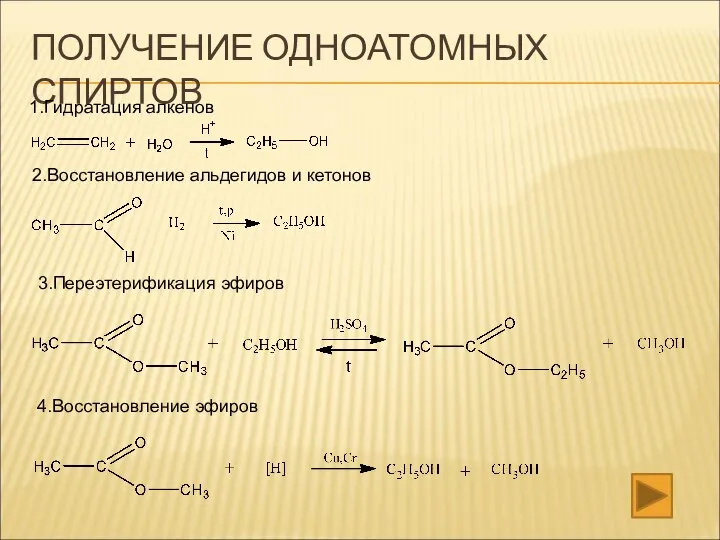
- 20. ПОЛУЧЕНИЕ ОДНОАТОМНЫХ СПИРТОВ 1.Гидратация алкенов 2.Восстановление альдегидов и кетонов 3.Переэтерификация эфиров 4.Восстановление эфиров
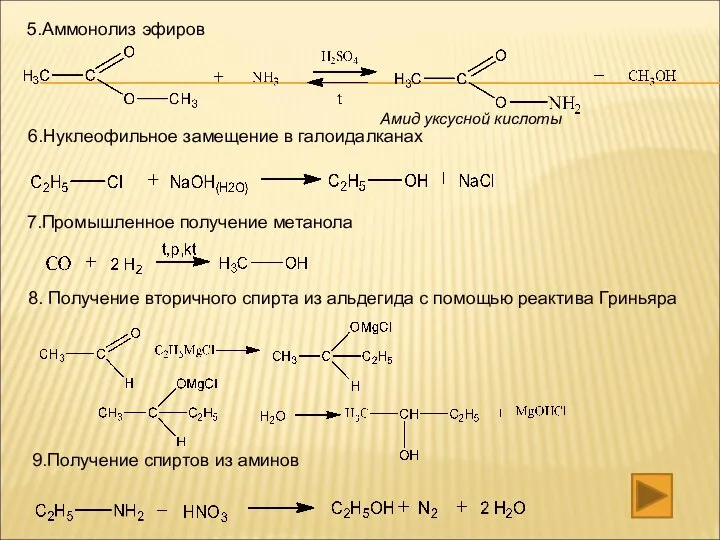
- 21. 5.Аммонолиз эфиров 6.Нуклеофильное замещение в галоидалканах 7.Промышленное получение метанола 8. Получение вторичного спирта из альдегида с
- 22. ПОЛУЧЕНИЕ МНОГОАТОМНЫХ СПИРТОВ 1.Неполное окисление алкенов в нейтральной среде Пропан 1,2-ол 2.Нуклеофильное замещение в дигалоидалканах 3.Промышленное
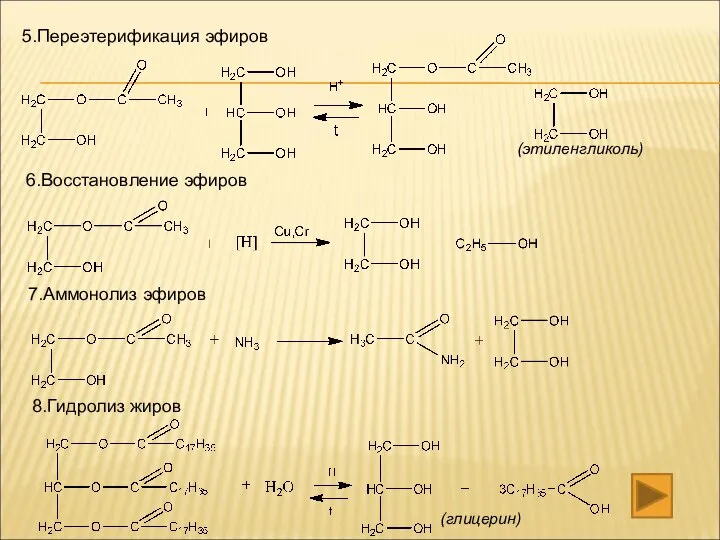
- 23. 5.Переэтерификация эфиров 6.Восстановление эфиров 7.Аммонолиз эфиров 8.Гидролиз жиров (этиленгликоль) (глицерин)
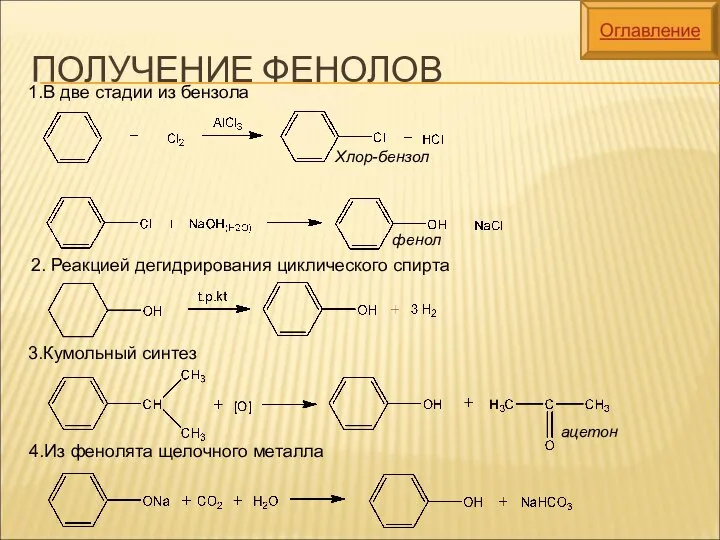
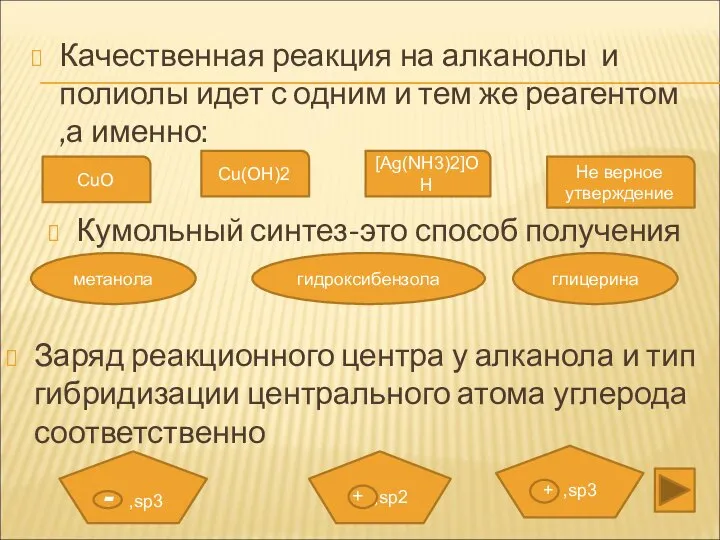
- 24. ПОЛУЧЕНИЕ ФЕНОЛОВ 1.В две стадии из бензола 2. Реакцией дегидрирования циклического спирта 3.Кумольный синтез 4.Из фенолята
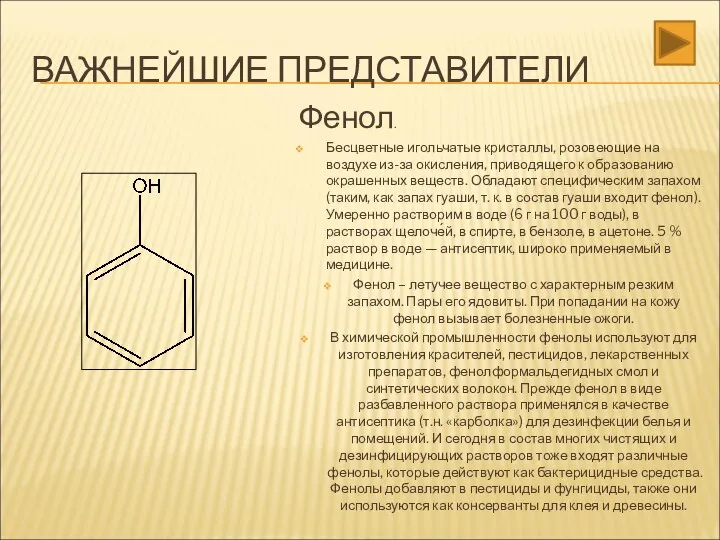
- 25. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Фенол. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ.
- 26. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Этанол Прозрачная бесцветная подвижная, летучая жидкость с характерным спиртовым запахом и жгучим вкусом. Легко
- 27. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Метанол Бесцветная жидкость с характерным запахом и температурой кипения 64,7. Горит чуть голубоватым пламенем.
- 28. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ Глицерин Глицерин — бесцветная, вязкая, очень гигроскопичная жидкость, смешивается с водой в любых пропорциях.
- 29. ПРОВЕРКА ЗНАНИЙ В следующем разделе нашего учебника Вы сможете проверить свои знания При выборе ответа на
- 30. ВОПРОС 1. Путем гидролиза эфиров можно получить спирт А. С разветвленной цепью Б. С неразветвленной цепью
- 31. Качественная реакция на алканолы и полиолы идет с одним и тем же реагентом ,а именно: CuO
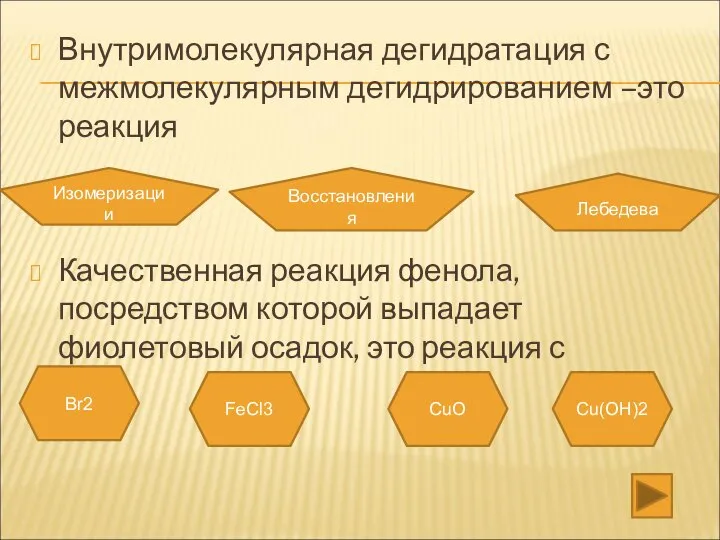
- 32. Внутримолекулярная дегидратация с межмолекулярным дегидрированием –это реакция Изомеризации Восстановления Лебедева Качественная реакция фенола, посредством которой выпадает
- 33. По «кислому» водороду реакция со щелочами идет у: Фенола, алканола Фенола, полиола У всех спиртов Алканола,полиола
- 34. Вещества, формулы которых CH3 – CH2 – OH и CH3 – O – CH3 являются Спиртами
- 35. При взаимодействии одноатомного спирта с 48%-й бромоводородной кислотой (плотность 1,5 г/мл) образовалось 49,2 г (0,4 моль)
- 36. Для нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40%-го раствора гидроксида калия (плотность 1,4
- 37. Благодарим за работу с нашим учебником!!! Надеемся, что он помог Вам В освоении ХИМИИ!!!!
- 40. Скачать презентацию


















 Строение атома
Строение атома Искусственные полимеры
Искусственные полимеры Алканы. Химические совйства
Алканы. Химические совйства Основные положения теории строения органических соединений А.М. Бутлерова
Основные положения теории строения органических соединений А.М. Бутлерова Растворы. Лекция 7
Растворы. Лекция 7 obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Определение площади поверхности и пористости материалов методом сорбции газов
Определение площади поверхности и пористости материалов методом сорбции газов Нефть и её переработка
Нефть и её переработка Управления реакций
Управления реакций Алкоголь и мозг
Алкоголь и мозг Reaktsii_ionnogo_obmena
Reaktsii_ionnogo_obmena Понятие о пестицидах. Меры безопасности при работе с ядами
Понятие о пестицидах. Меры безопасности при работе с ядами Коррозия металлов
Коррозия металлов Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5) Угольная кислота и ее соли
Угольная кислота и ее соли Кремний – химический элемент или природный дар
Кремний – химический элемент или природный дар Генетическая связь между основными классами неорганических соединений
Генетическая связь между основными классами неорганических соединений Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Презентация на тему Железо
Презентация на тему Железо  Вдоль по радуге
Вдоль по радуге Строение вещества. Эксперименты
Строение вещества. Эксперименты Фармацевтическая химия субстанций. Лекция 5
Фармацевтическая химия субстанций. Лекция 5 Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry
Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry Презентация на тему Теория электролитической диссоциации.
Презентация на тему Теория электролитической диссоциации.  Сера, значение и применение
Сера, значение и применение Природные источники углеводородов
Природные источники углеводородов