Слайд 2Основные положения этого метода:
в образовании связи участвуют только электроны внешней электронной оболочки

атома (валентные электроны);
химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных орбиталей и между атомами появляется область с повышенной электронной плотностью, обусловливающая связь между ядрами атомов. Таким образом, в основе метода ВС лежит образование двухэлектронной, двухцентровой связи;
Слайд 3химическая связь осуществляется в том направлении, в котором обеспечивается наибольшее перекрывание атомных

орбиталей;
из нескольких связей данного атома наиболее прочной будет связь, которая получилась в результате наибольшего перекрывания атомных орбиталей;
при образовании молекул электронная структура (кроме внешней электронной оболочки) и химическая индивидуальность каждого атома в основном сохраняются.
Ковалентная связь обладает рядом важных свойств. К их числу относится насыщаемость и направленность.
Слайд 4Насыщаемость –
характерное свойство ковалентной связи. Она проявляется в способности атомов образовывать ограниченное

число ковалентных связей. Это связано с тем, что одна орбиталь атома может принимать участие в образовании только одной ковалентной химической связи. Данное свойство определяет состав молекулярных химических соединений.
Слайд 5Направленность –
свойство ковалентной связи, определяющее геометрическую структуру молекулы. Причина направленности связи

заключается в том, что перекрывание электронных орбиталей возможно только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания, когда образуется прочная химическая связь. С направленностью связей тесно связан вопрос о гибридизации орбиталей.
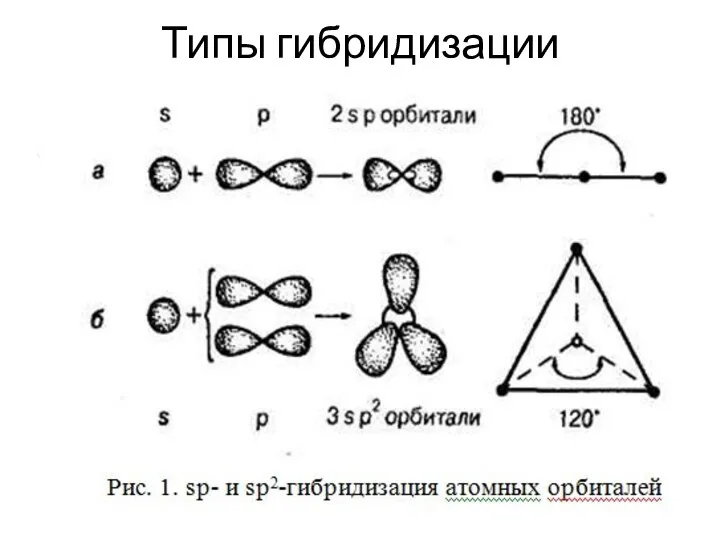
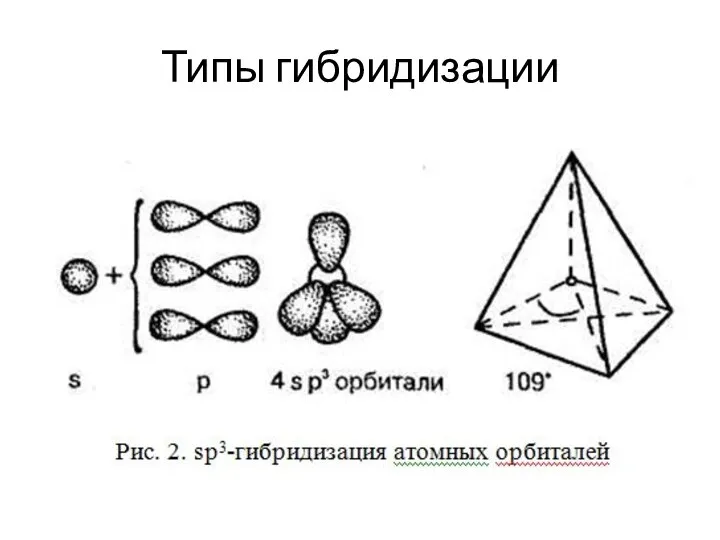
Слайд 6Теория гибридизации
Гибридные орбитали, возникающие в результате взаимодействия различных атомных орбиталей, имеют уже

одинаковую форму. Они вытянуты в сторону соседних атомов, и поэтому достигается более полное перекрывание с электронными орбиталями этих атомов.
Процесс гибридизации связан с затратой определенной энергии. Эту затрату компенсирует избыток энергии, который выделяется при образовании более прочной химической связи при перекрывании гибридных орбиталей. Таким образом, гибридизация приводит к уменьшению энергии образующейся молекулы, к ее большей устойчивости.
Слайд 7Основные принципы гибридизации:
Участвующие в гибридизации атомные орбитали должны иметь близкие значения энергии.
Число

гибридных орбиталей должно быть равно числу исходных атомных орбиталей.
Гибридные атомные орбитали представляют собой линейные комбинации исходных орбиталей.
Гибридные орбитали располагаются в пространстве так, чтобы обеспечить между ними минимальное отталкивание.






 Органическая химия. Классификация. Номенклатура
Органическая химия. Классификация. Номенклатура Номенклатура органических соединений. Упражнения
Номенклатура органических соединений. Упражнения Ковалентная полярная связь
Ковалентная полярная связь Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Физический этап развития периодического закона
Физический этап развития периодического закона a319f492a6071afff03d7efc722c906b
a319f492a6071afff03d7efc722c906b Первоначальные химические понятия
Первоначальные химические понятия Диеновые углеводороды. Алкадиены
Диеновые углеводороды. Алкадиены Алканы
Алканы Медь и ее сплавы
Медь и ее сплавы Классификация силикатов
Классификация силикатов День химии
День химии Аминокислоты. Пептиды. Белки. Тема 2
Аминокислоты. Пептиды. Белки. Тема 2 Металлы - наши друзья или враги
Металлы - наши друзья или враги Решение расчетных задач
Решение расчетных задач Теория электролитической диссоциации
Теория электролитической диссоциации Силумины. Виды силуминов
Силумины. Виды силуминов Пористые стекла
Пористые стекла Масс-спектрометрия шерсти волка обыкновенного Canis lupus
Масс-спектрометрия шерсти волка обыкновенного Canis lupus Звездный час по химии
Звездный час по химии Ионная полимеризация
Ионная полимеризация Повторение по теме Химические реакции
Повторение по теме Химические реакции Химия - неотъемлемая часть жизни
Химия - неотъемлемая часть жизни Мастер - класс: Окислительно-восстановительные реакции
Мастер - класс: Окислительно-восстановительные реакции Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты
Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты Получение и реакции пиразина
Получение и реакции пиразина Алюминий. Из истории открытия
Алюминий. Из истории открытия Бораны и карбораны
Бораны и карбораны