Содержание
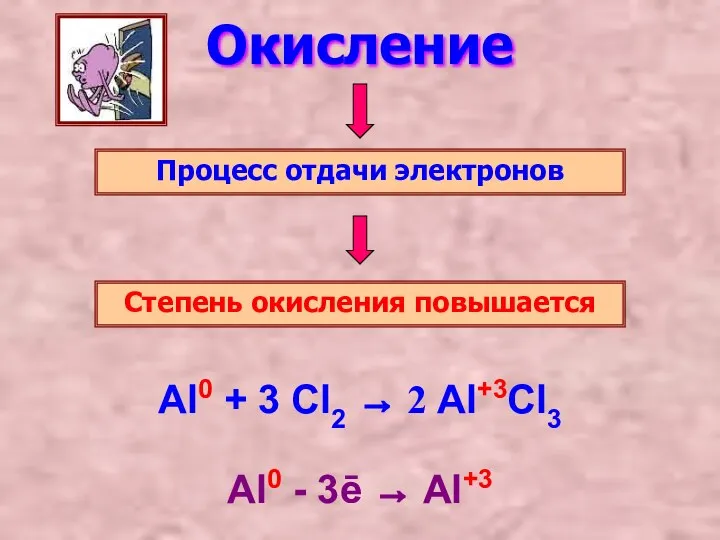
- 2. Окисление Процесс отдачи электронов Степень окисления повышается Al0 - 3ē → Al+3 Al0 + 3 Cl2
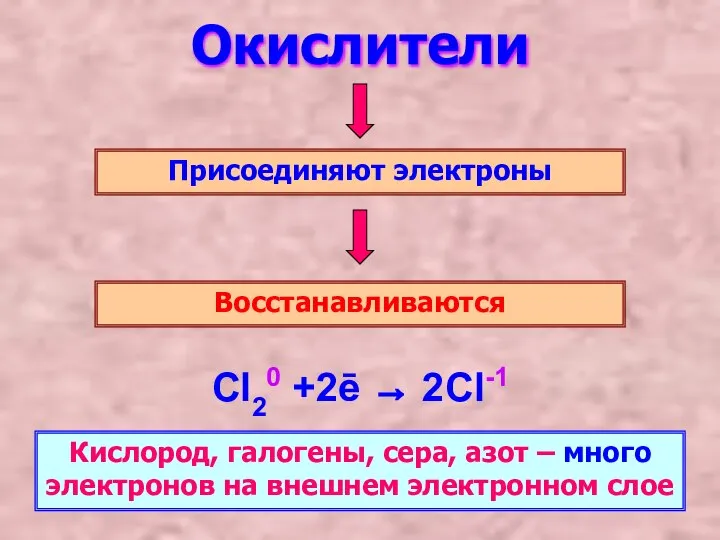
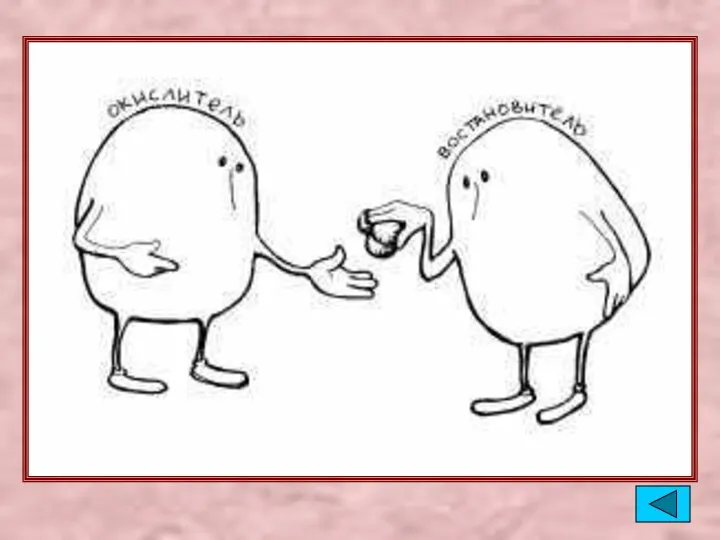
- 3. Окислители Присоединяют электроны Восстанавливаются Cl20 +2ē → 2Cl-1 Кислород, галогены, сера, азот – много электронов на
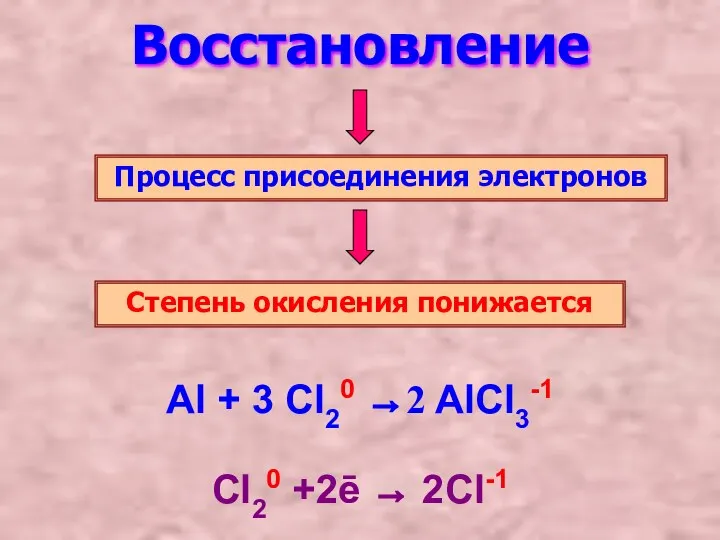
- 4. Восстановление Процесс присоединения электронов Степень окисления понижается Al + 3 Cl20 →2 AlCl3-1 Cl20 +2ē →
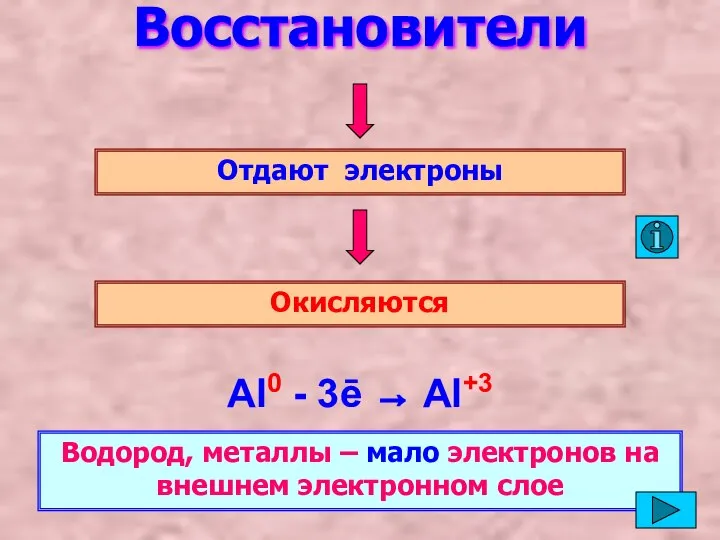
- 5. Восстановители Отдают электроны Окисляются Al0 - 3ē → Al+3 Водород, металлы – мало электронов на внешнем
- 7. ОВР – окислительно-восстановительные реакции Реакции в которых происходит изменение степени окисления Zn0 + 2H+1 Cl →
- 8. Окислитель восстанавливается, его степень окисления уменьшается Восстановитель окисляется, его степень окисления увеличивается 2 Na0 + Cl2
- 9. Положительный Восстановился
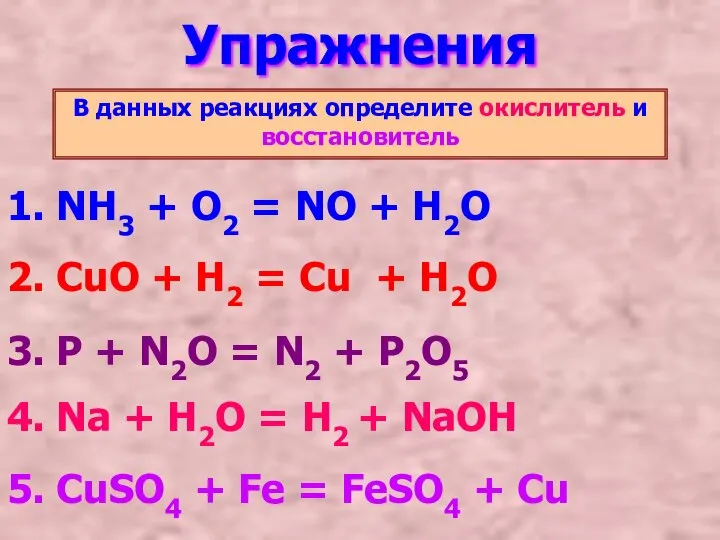
- 10. Упражнения В данных реакциях определите окислитель и восстановитель 1. NH3 + O2 = NO + H2O
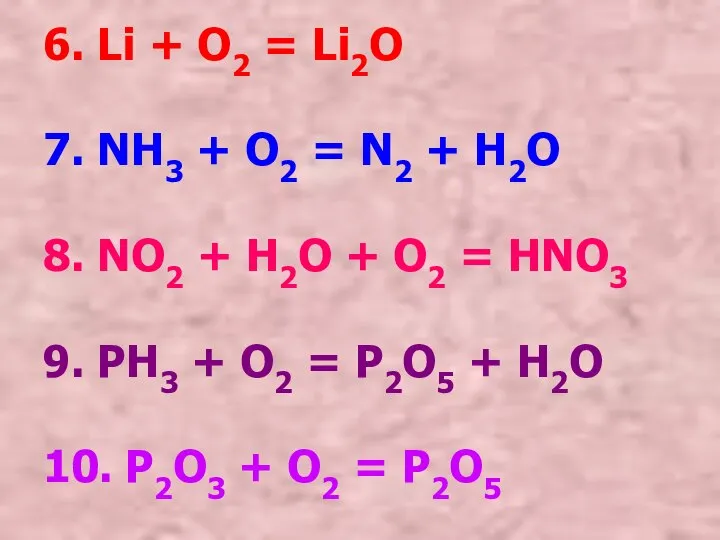
- 11. 6. Li + O2 = Li2O 7. NH3 + O2 = N2 + H2O 8. NO2
- 13. Скачать презентацию



 Основные соединения кальция и их применение – вчера, сегодня, завтра.
Основные соединения кальция и их применение – вчера, сегодня, завтра. Клуб юных химиков. Школа №3
Клуб юных химиков. Школа №3 Аморфные и кристаллические вещества
Аморфные и кристаллические вещества Материаловедение
Материаловедение Классификация неорганических веществ
Классификация неорганических веществ Степень окисления
Степень окисления Перспективы использования микроволнового излучения в органической химии
Перспективы использования микроволнового излучения в органической химии Оксиды
Оксиды Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Защитить кабель. Задача 9
Защитить кабель. Задача 9 Синтетические высокомолекулярные органические вещества
Синтетические высокомолекулярные органические вещества Органическая химия
Органическая химия Презентация на тему Полимеразная цепная реакция (ПЦР)
Презентация на тему Полимеразная цепная реакция (ПЦР) 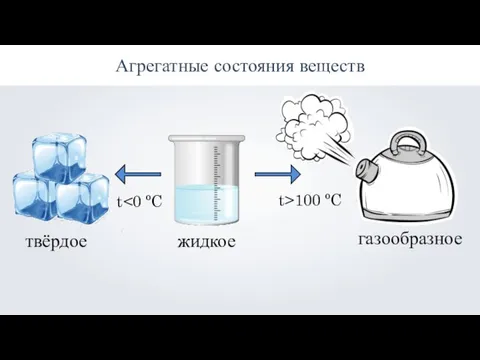 Агрегатные состояния веществ: твёрдое, жидкое, газообразное
Агрегатные состояния веществ: твёрдое, жидкое, газообразное Реакции замещения
Реакции замещения Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Тема урока: «Серная кислота» 9 класс
Тема урока: «Серная кислота» 9 класс Классы неорганических соединений
Классы неорганических соединений Общая характеристика элементов группы, главной подгруппы
Общая характеристика элементов группы, главной подгруппы Газообразные дисперсные системы (Аэрозоли)
Газообразные дисперсные системы (Аэрозоли) Кислоты в химии
Кислоты в химии Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Органическая химия: Жиры
Органическая химия: Жиры Органическая химия. Введение
Органическая химия. Введение Долговечность пластмасс
Долговечность пластмасс Карбоновые кислоты
Карбоновые кислоты Химические свойства
Химические свойства Массовые доли веществ задачи
Массовые доли веществ задачи