Слайд 2Правила определение степени окисления :
1) Степень окисления элемента в простом веществе равна

нулю
Например, Н20, О20, Fe0, Na0 и т.д.
Для сложных веществ:
1)для фтора степень окисления равна: -1;
2)для кислорода: (-2), за исключением пероксидов, где ст.ок. равна -1, и О+2F2
3)для водорода степень окисления равна +1, за исключением гидридов- Li+1H-1
Слайд 34)Степень окисления металлов всегда положительна и равна номеру группы (для металлов главных

подгрупп)
5)Максимальная ст.ок. химического элемента равна номеру группы, минимальная (номер группы-8)-для ХЭ начиная с 4 группы.
6) Алгебраическая сумма степеней окисления элементов в нейтральной молекуле равна нулю, в сложном ионе - заряду иона.
Слайд 4
Основные положения теории ОВР
Окислением называют процесс отдачи электронов атомом, молекулой или ионом.

Степень окисления при этом повышается.
А10 -3ē ? А1+3
S-2 - 2ē ? S0
Атомы, молекулы или ионы, отдающие электроны, называют восстановителями.
S-2 - ?ē ? S+6
Слайд 5Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при

этом понижается.
Mn+7 +5ē → Mn+2
А1+3 +3ē → Al0
Атомы, молекулы или ионы, присоединяющие электроны, называют окислителями.
Слайд 6O20 → 2O-2
N20 → 2N-3
Cl+5 → Cl-1
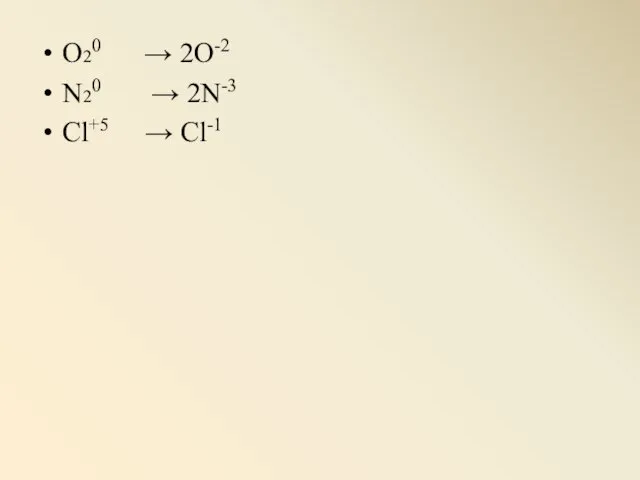
Слайд 7Метод электронного баланса
Метод основан на сравнении степеней окисления атомов в исходных и

конечных веществах.
Число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем.
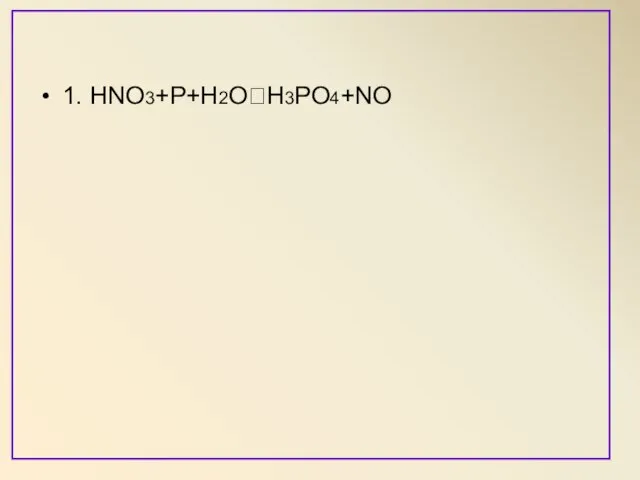
Слайд 8Составление уравнений ОВР необходимо провести в несколько стадий:
1)определить степени окисления элементов

в исходных веществах и продуктах реакции;
2)определить число электронов, отдаваемых восстановителем и принимаемых окислителем, составить электронные уравнения;
3)уравнять число электронов между окислителем и восстановителем, подобрать коэффициенты при восстановителе и окислителе;
4)уравнять число атомов всех элементов




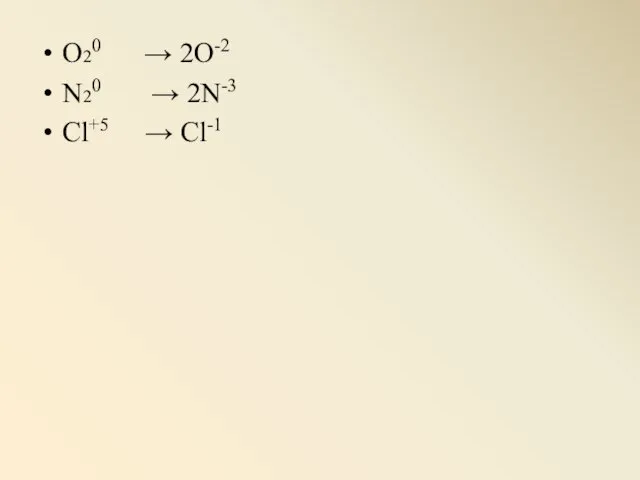


 Оксиды азота
Оксиды азота Особенности базового курса органической химии издательства «ОЛМА»
Особенности базового курса органической химии издательства «ОЛМА» Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Карбоновые кислоты
Карбоновые кислоты Смачивание и не смачивание жидкости. Капилляры
Смачивание и не смачивание жидкости. Капилляры Углерод
Углерод Расстворение. Расстворы
Расстворение. Расстворы Аллотропия Аллотропные видоизменения (модификации)
Аллотропия Аллотропные видоизменения (модификации) Якісні реакції органічних речовин
Якісні реакції органічних речовин Окислительно-восстановительные свойства неорганических кислот
Окислительно-восстановительные свойства неорганических кислот Образование химических связей
Образование химических связей Коррозия металлов
Коррозия металлов Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде История развития химии
История развития химии Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Висмут Bi
Висмут Bi Химические реактивы
Химические реактивы Презентация на тему Минеральные вещества
Презентация на тему Минеральные вещества  Водные растворы электролитов
Водные растворы электролитов Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12 Group 6 Cations
Group 6 Cations Spectroscopy. U.V. Lect.2
Spectroscopy. U.V. Lect.2 Эмульсия. Основные типы эмульсий
Эмульсия. Основные типы эмульсий Обобщение и систематизация знаний по теме Углеводороды
Обобщение и систематизация знаний по теме Углеводороды Степень окисления
Степень окисления Изотопная геохимия. Лекция 4-5
Изотопная геохимия. Лекция 4-5 Азот
Азот Лекция 4 Строение атома
Лекция 4 Строение атома