Содержание
- 2. СЕГОДНЯ НА УРОКЕ ВЫ УЗНАЕТЕ: Понятие о непредельных углеводородах . Характеристика тройной связи. Изомерия и номенклатура
- 3. ПОНЯТИЕ ОБ АЛКИНАХ Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а
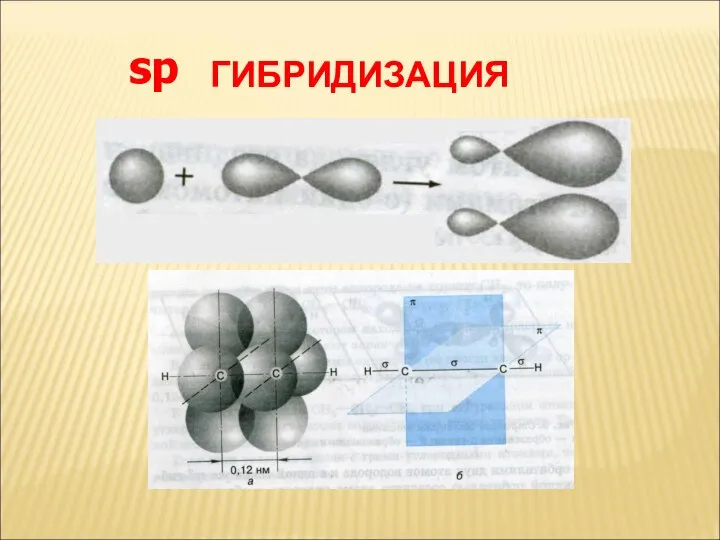
- 4. ХАРАКТЕРИСТИКА ТРОЙНОЙ СВЯЗИ Вид гибридизации – sp Валентный угол – 180 Длина связи С = С
- 5. ГИБРИДИЗАЦИЯ sp
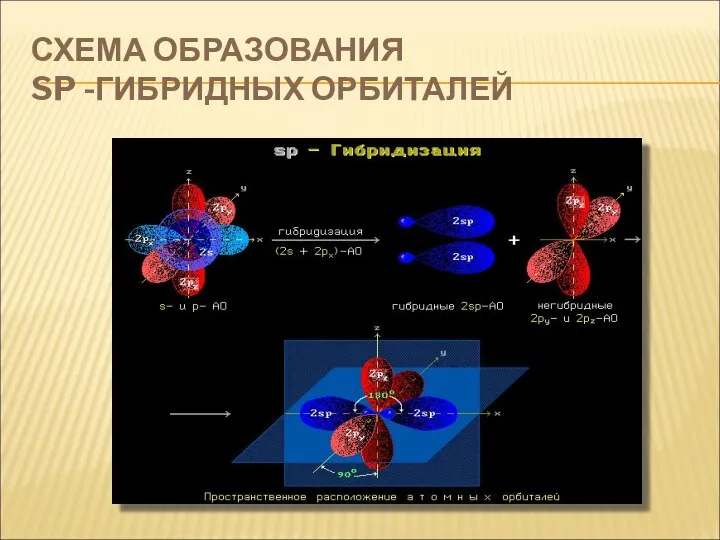
- 6. СХЕМА ОБРАЗОВАНИЯ SP -ГИБРИДНЫХ ОРБИТАЛЕЙ
- 7. СХЕМА ОБРАЗОВАНИЯ SP -ГИБРИДНЫХ ОРБИТАЛЕЙ
- 8. ГОМОЛОГИЧЕСКИЙ РЯД АЛКИНОВ C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин Пропин Бутин Пентин Гексин Гептин
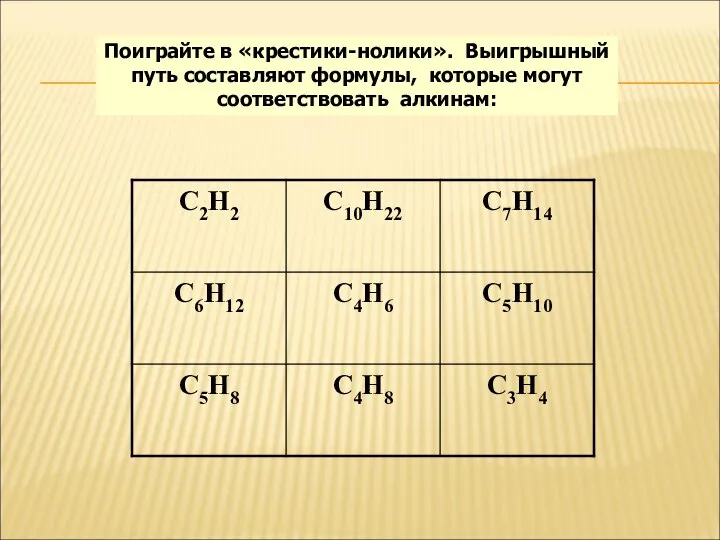
- 9. Поиграйте в «крестики-нолики». Выигрышный путь составляют формулы, которые могут соответствовать алкинам:
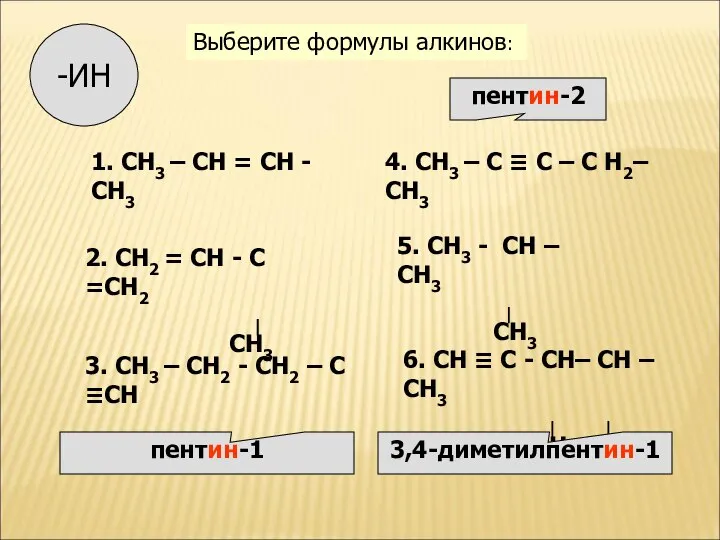
- 10. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
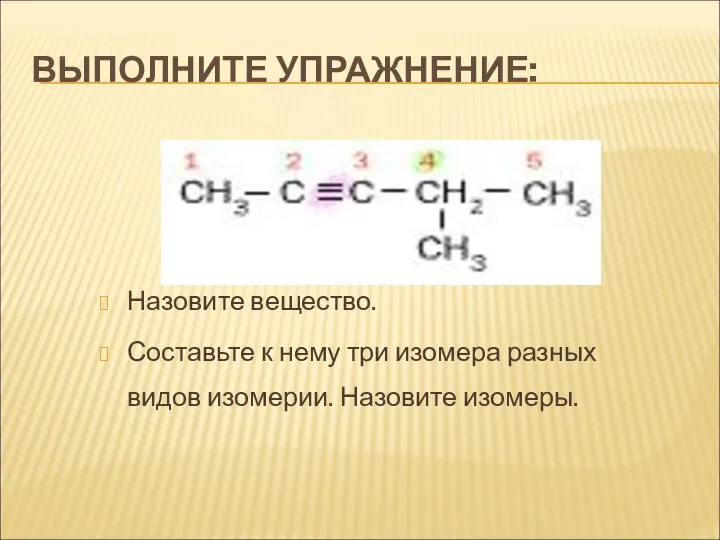
- 11. ВЫПОЛНИТЕ УПРАЖНЕНИЕ: Назовите вещество. Составьте к нему три изомера разных видов изомерии. Назовите изомеры.
- 12. 1. СН3 – СН = СН -СН3 2. СН2 = СН - С =СН2 ∣ СН3
- 13. ФИЗИЧЕСКИЕ СВОЙСТВА Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении
- 14. Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 1500°С 2СН4 ⎯⎯→ С2Н2 + 3Н2
- 15. ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах
- 16. РЕАКЦИИ ПРИСОЕДИНЕНИЯ 1. Галогенирование Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды
- 17. 2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H] ⎯→ CH3−C−H ⏐ ⏐
- 18. ОКИСЛЕНИЕ Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
- 19. ГОРЕНИЕ АЦЕТИЛЕНА При сгорании (полном окислении) ацетилена выделяется большое количества тепла: HC≡CH + 2О2 ⎯→ 2СО2
- 20. РЕАКЦИИ ЗАМЕЩЕНИЯ При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
- 21. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ 1. Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
- 23. Скачать презентацию










![2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1122104/slide-16.jpg)




 Изучение свойств анилина. Лабораторная работа №18
Изучение свойств анилина. Лабораторная работа №18 Кислоты в химии
Кислоты в химии Азотная кислота
Азотная кислота Кремний и его соединения
Кремний и его соединения Спирт. Виды спиртов
Спирт. Виды спиртов Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа Фосфор и его соединения. Минеральные удобрения
Фосфор и его соединения. Минеральные удобрения Ароматические углеводороды
Ароматические углеводороды Чемпионат НХЛ (национальной химической лиги)
Чемпионат НХЛ (национальной химической лиги) Буферные системы
Буферные системы Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение
Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение Винная кислота
Винная кислота СПИРТЫ, ФЕНОЛЫ
СПИРТЫ, ФЕНОЛЫ Слюда. История открытия
Слюда. История открытия Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ Диффузия и осмос
Диффузия и осмос Золото
Золото Алюминий
Алюминий Prezentatsia_k_uroku
Prezentatsia_k_uroku Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Классификация реакций
Классификация реакций Материаловедение. Методы исследования в материаловедении (лекция 1)
Материаловедение. Методы исследования в материаловедении (лекция 1) Ароматические углеводороды. Строение молекулы бензола. Физические свойства
Ароматические углеводороды. Строение молекулы бензола. Физические свойства Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение Предельные углеводороды. Лекция 2
Предельные углеводороды. Лекция 2 Химия и жизнь
Химия и жизнь Графический диктант. Азот и Аммиак
Графический диктант. Азот и Аммиак