Содержание
- 2. Алка́ны - - это насыщенные алифатические (не содержащие ароматических связей) углеводороды, парафины — ациклические — ациклические
- 3. Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водородауглеводородами и содержат максимально возможное число
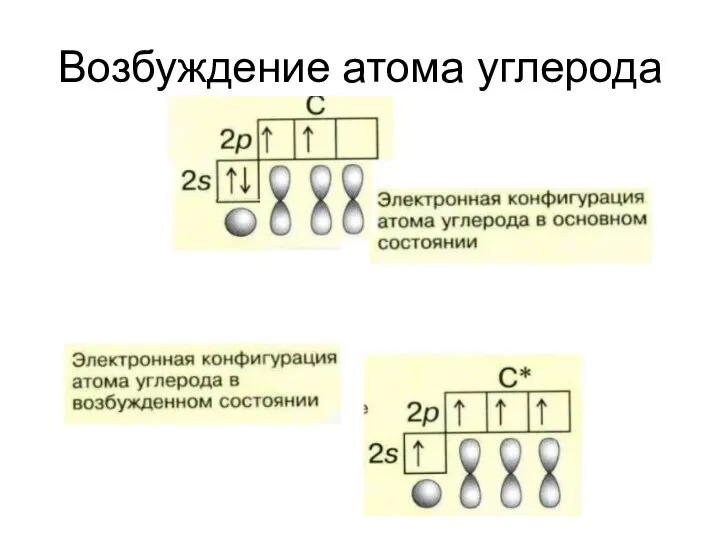
- 4. Возбуждение атома углерода
- 7. Алканы образуют гомологический ряд. Первые 10 членов Метан CH4 CH4 Этан CH3—CH3 C2H6 Пропан CH3—CH2—CH3 C3H8
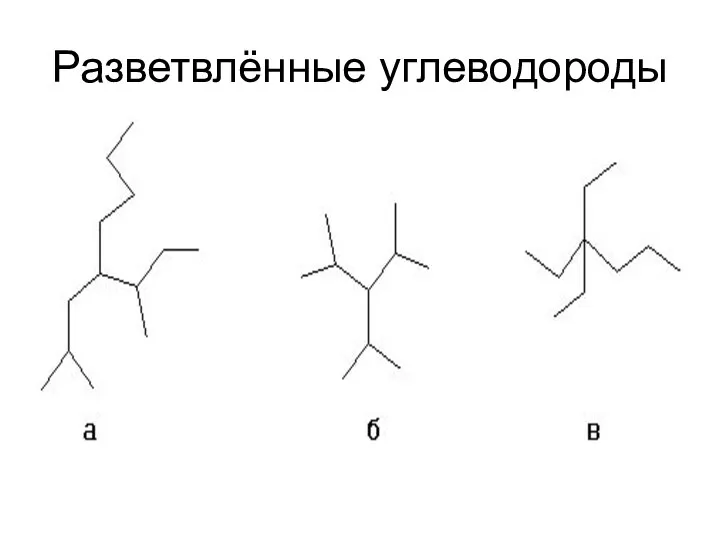
- 8. Разветвлённые углеводороды
- 9. Изомерия n Число изомеров 4 2 5 3 6 5 7 9 8 18 9 35
- 10. Номенклатура Тривиальная Рациональная (заместительная) Систематическая (IUPAС)
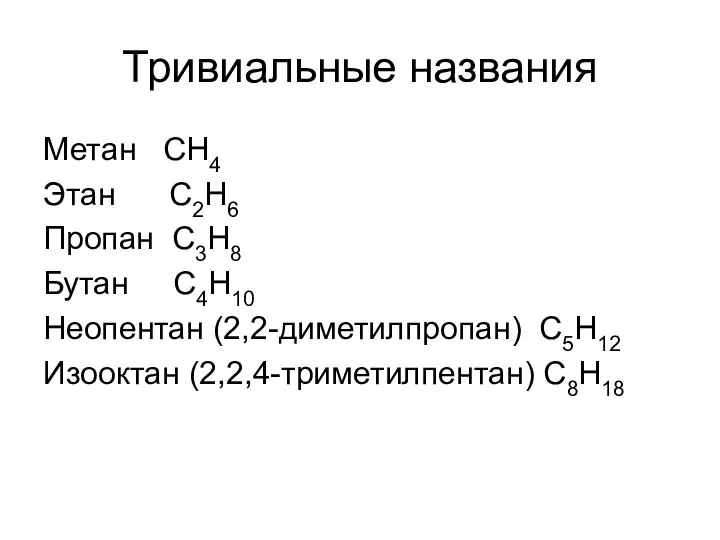
- 11. Тривиальные названия Метан СН4 Этан С2Н6 Пропан С3Н8 Бутан С4Н10 Неопентан (2,2-диметилпропан) С5Н12 Изооктан (2,2,4-триметилпентан) С8Н18
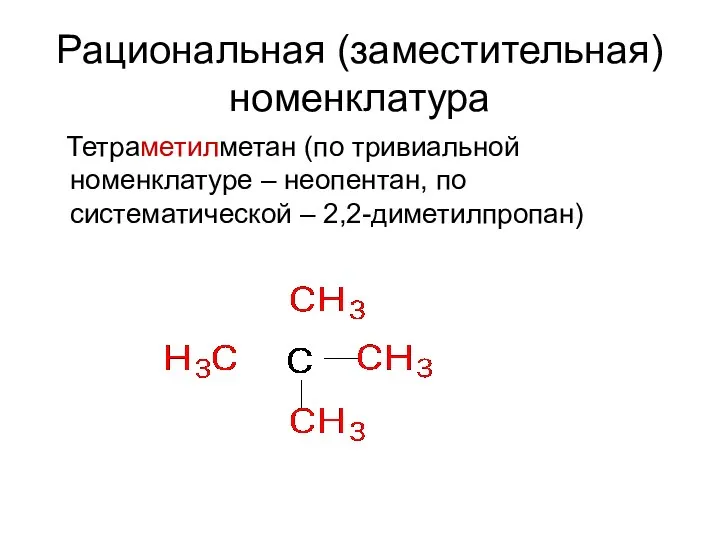
- 12. Рациональная (заместительная) номенклатура Тетраметилметан (по тривиальной номенклатуре – неопентан, по систематической – 2,2-диметилпропан)
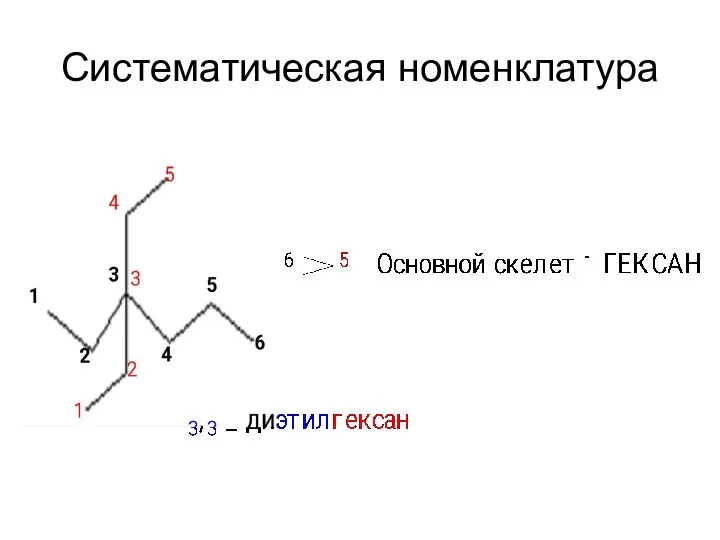
- 13. Систематическая номенклатура 1. За основу названия данного соединения берут название углеводорода, соответствующее числу углеродных атомов главной
- 14. Систематическая номенклатура 2. После установления главной цепи необходимо пронумеровать углеродные атомы. Нумерацию начинают с того конца
- 15. Систематическая номенклатура Называя соединение, сначала перечисляют заместители (радикалы) в алфавитном порядке (числительные не принимают во внимание),
- 16. Систематическая номенклатура Если на основном углеродном скелете содержится несколько одинаковых радикалов, то число их обозначают греческим
- 17. Систематическая номенклатура Радикалы называют, заменяя суффикс -ан в названии углеводорода на -ил: метил CH3— этил CH3—CH2—
- 18. Систематическая номенклатура
- 19. Физические свойства Температуры плавленияТемпературы плавления и кипения увеличиваются с ростом молекулярной массы и длины главной углеродной
- 20. Химические свойства Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C
- 21. Энергия связей В нормальных алканах с длинной цепью энергия разрыва С—С- и С—Н-связей несколько уменьшается к
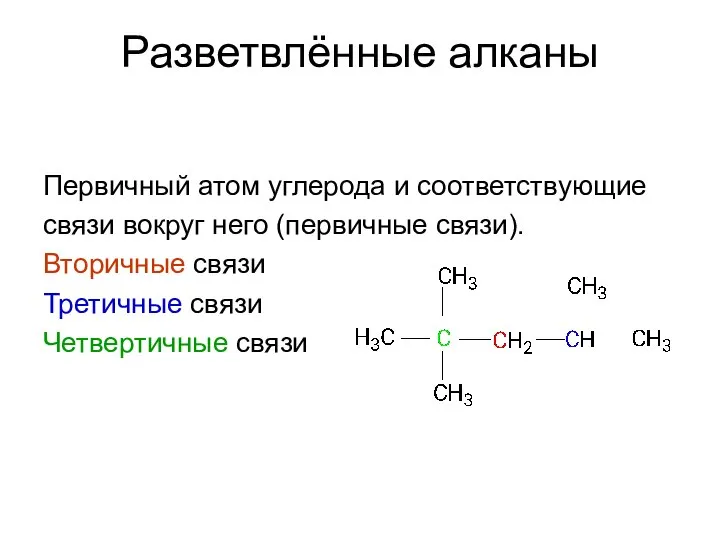
- 22. Разветвлённые алканы Первичный атом углерода и соответствующие связи вокруг него (первичные связи). Вторичные связи Третичные связи
- 23. Реакции радикального замещения ГАЛОГЕНИРОВАНИЕ СУЛЬФОХЛОРИРОВАНИЕ (Реакция Рида) НИТРОВАНИЕ (Реакция Коновалова) АВТООКИСЛЕНИЕ
- 24. Галогенирование Под действием света молекула хлора распадается на радикалы, затем эти радикалы атакуют молекулы алкана, отрывая
- 25. Механизм галогенирования Инициирование цепного процесса: hν Cl2 → 2 Cl. Зарождение цепи: RH + Cl. →
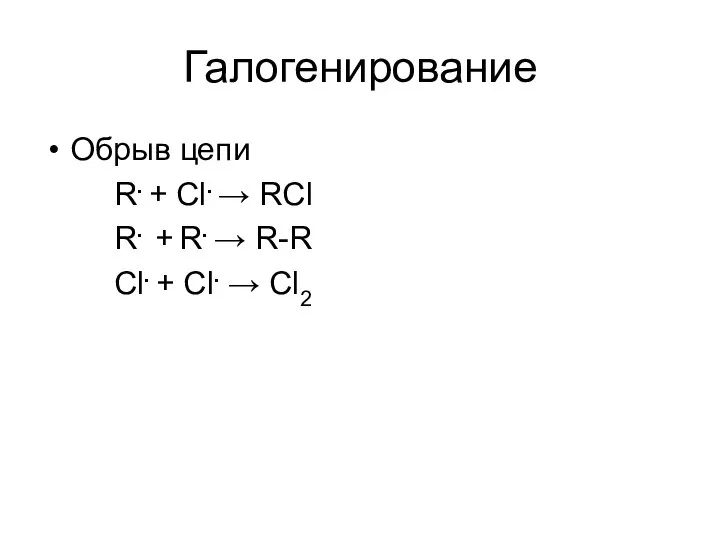
- 26. Галогенирование Обрыв цепи R. + Cl. → RCl R. + R. → R-R Cl. + Cl.
- 27. Галогенирование Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных,
- 28. Галогенирование Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
- 29. Галогенирование С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом
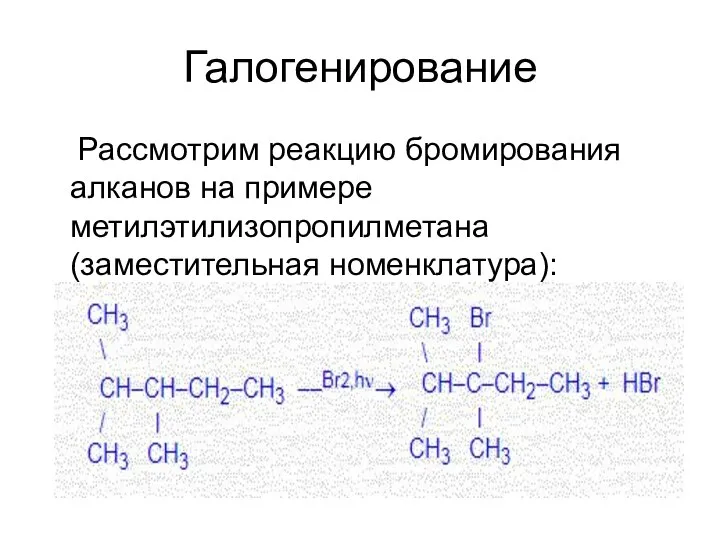
- 30. Галогенирование Рассмотрим реакцию бромирования алканов на примере метилэтилизопропилметана (заместительная номенклатура):
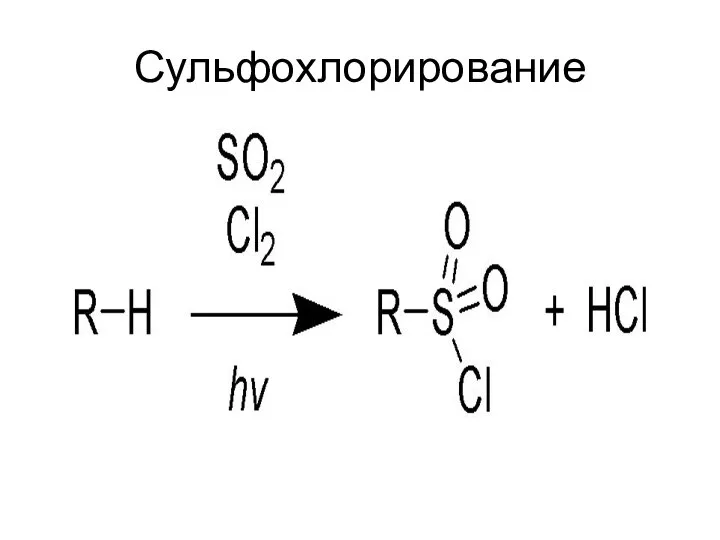
- 31. Сульфохлорирование
- 32. Механизм сульфохлорирования Инициирование цепного процесса: hν Cl2 → 2 Cl. Развитие цепного процесса: RH + Cl.
- 33. Нитрование Алканы реагируют с 10 % раствором азотной кислоты Алканы реагируют с 10 % раствором азотной
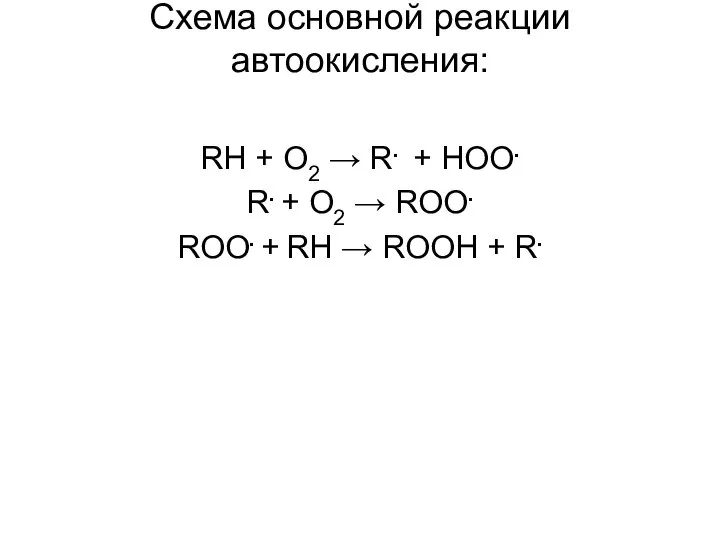
- 34. Автоокисление Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов
- 35. Схема основной реакции автоокисления: RH + O2 → R. + HOO. R. + O2 → ROO.
- 36. Реакции окисления Окисление Каталитическое окисление Горение
- 37. Горение СnH2n+2 + (3n+1)/2 O2 → → nCO2 + (n+1)H2O +Q Значение Q достигает 46 000
- 38. Каталитическое окисление В реакциях каталитического окисления алканов могут образовываться спирты, альдегидыВ реакциях каталитического окисления алканов могут
- 39. Каталитическое окисление Окисление также может осуществляться кислородом воздуха. Процесс проводится в жидкой или газообразной фазе. В
- 40. Термические превращения алканов Крекинг Дегидрирование Дегидроциклизация Изомеризация
- 41. Энергия С—Н-связей в алканах всегда выше энергии С—С-связи. Например, энергия, необходимая для разрыва С—С- и С—Н-связей
- 42. Особые процессы В присутствии никелевого катализатора протекает реакция: СН4 + Н2О → СО + 3 Н2
- 43. Получение алканов Реакции восстановления Реакции гидрирования непредельных углеводородов Реакция Вюрца Синтез Фишера-Тропша
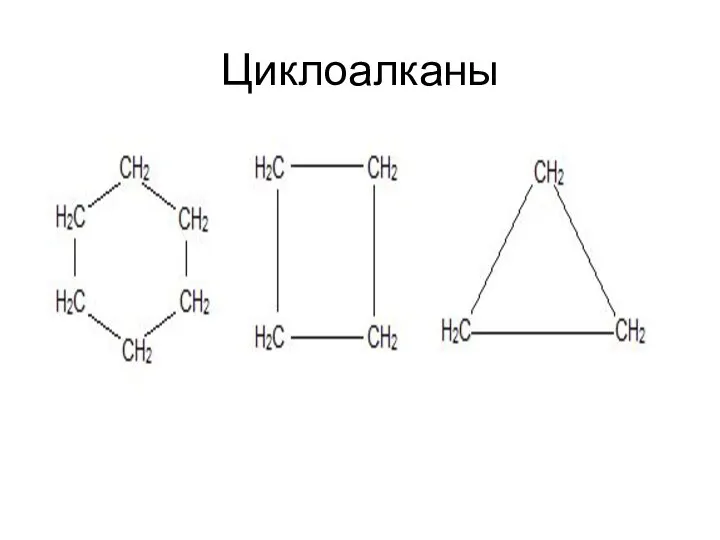
- 44. Циклоалканы - - или полиметиленовые углеводороды, нафтены, цикланы, или циклопарафины — циклические насыщенные углеводороды — циклические
- 45. Общая формула полиметилены СnH2n Связи С—С в циклоалканах несколько менее прочны, чем в нормальных алканах: в
- 46. Циклоалканы
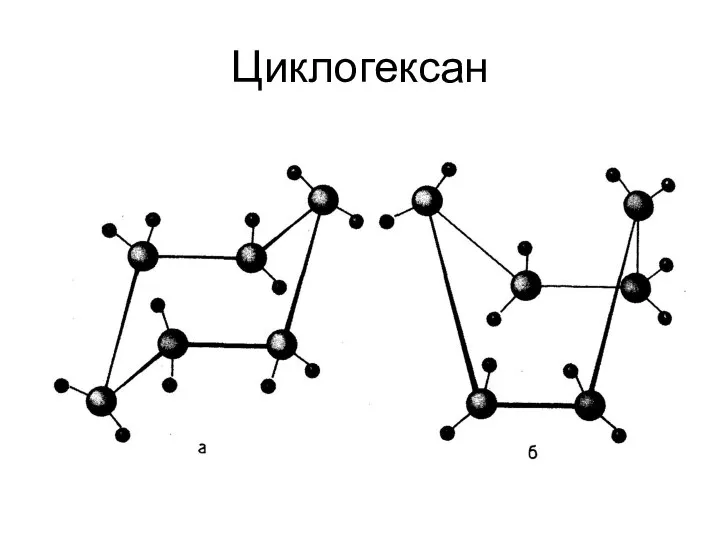
- 47. Циклогексан
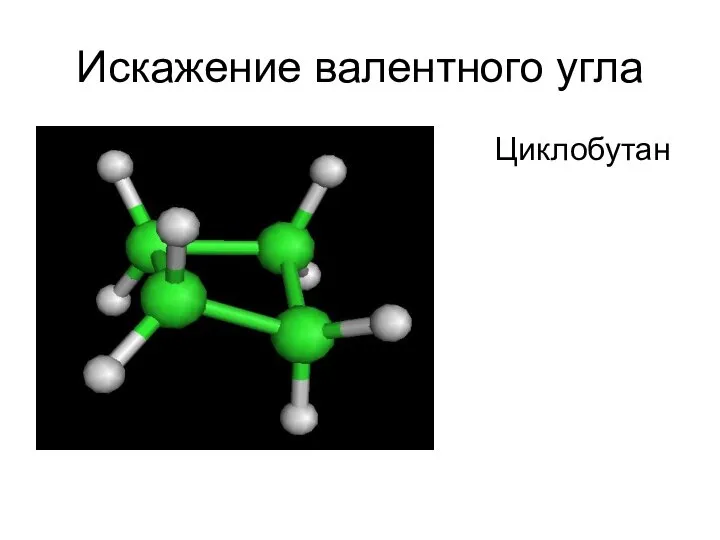
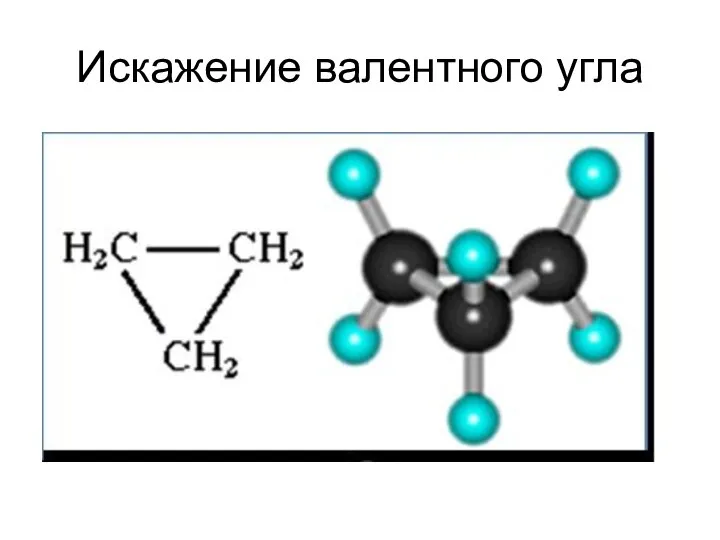
- 48. Искажение валентного угла Циклобутан
- 49. Искажение валентного угла
- 50. Свойства циклоалканов Реакции замещения для крупных циклов (n ≥ 5) Реакции присоединения для неустойчивых циклов Дегидрирование
- 52. Скачать презентацию



































 Молекулярно-массовое распределение
Молекулярно-массовое распределение Приходченко ФЕР-2031
Приходченко ФЕР-2031 Карбоновые кислоты
Карбоновые кислоты Циклоалканы. Строение молекул
Циклоалканы. Строение молекул Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4)
Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4) карбоновые кислоты
карбоновые кислоты Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства
Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства Презентация на тему Сложные эфиры
Презентация на тему Сложные эфиры  Соли (8 класс)
Соли (8 класс) 564481
564481 Природные смолы: канифоль, янтарь, сандарак (2)
Природные смолы: канифоль, янтарь, сандарак (2) Своя игра по химии
Своя игра по химии Хромофорная теория кислотно-основных индикаторов
Хромофорная теория кислотно-основных индикаторов Валентные возможности атомов элементов
Валентные возможности атомов элементов Исследование молока
Исследование молока Алмаз (С)
Алмаз (С) Обозначения групп симметрии по Шенфлису
Обозначения групп симметрии по Шенфлису lektsia_5
lektsia_5 Презентация на тему Предельные одноатомные спирты
Презентация на тему Предельные одноатомные спирты  Методы изготовления из резины и латекса
Методы изготовления из резины и латекса Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки
Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки Спирты и фенолы
Спирты и фенолы 10 класс Алкадиены более совершенная (2)
10 класс Алкадиены более совершенная (2) Азот и его соединения
Азот и его соединения Основания. Классификация
Основания. Классификация teoria_Butlerova
teoria_Butlerova Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс) 9 урок простые и сложные вещества
9 урок простые и сложные вещества