Содержание
- 2. Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. По мере открытия новых химических элементов,
- 3. В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных
- 4. При переходе от лития к фтору происходит закономерное ослабление металлических свойств и усиление неметаллических. При переходе
- 5. Если написать ряды один под другим так, чтобы под литием находился натрий, а под неоном –
- 6. Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
- 7. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной
- 8. Уязвимым моментом периодического закона сразу после его открытия было объяснение причины периодического повторения свойств элементов с
- 9. Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что
- 10. Открытый Д. И. Менделеевым закон и построенная на основе закона периодическая система элементов - это важнейшее
- 11. Периодическая таблица химических элементов Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на
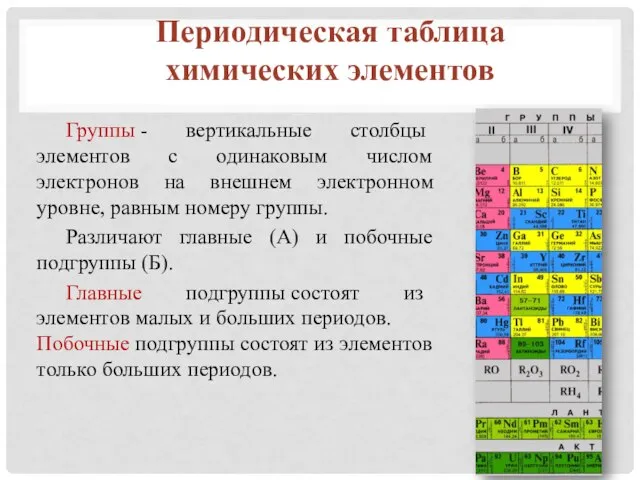
- 12. Периодическая таблица химических элементов Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном
- 13. Поскольку окислительно – восстановительные свойства атомов оказывают влияние на свойства простых веществ и их соединений, то
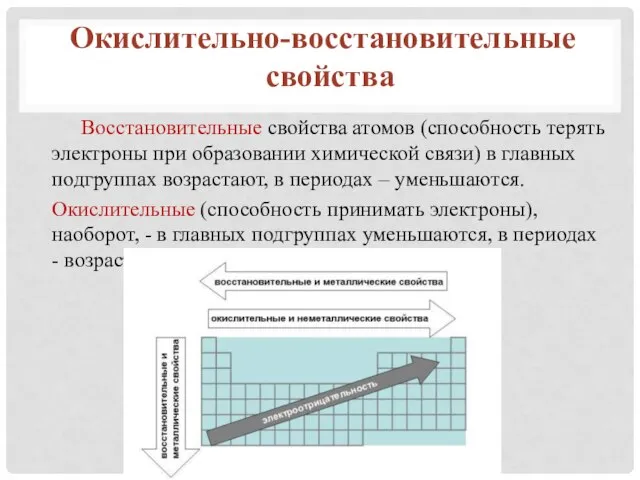
- 14. Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в главных подгруппах возрастают, в периодах
- 15. Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо. В группе
- 16. Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к. притяжение ядром электронных оболочек усиливается.
- 17. В одной и той же группе с увеличением номера периода атомные радиусы возрастают. Атомы металлов сравнительно
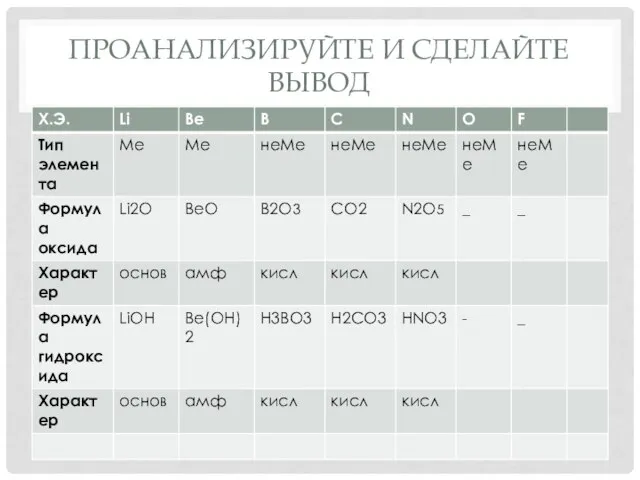
- 18. ПРОАНАЛИЗИРУЙТЕ И СДЕЛАЙТЕ ВЫВОД
- 20. Скачать презентацию














 Презентация на тему Палладий
Презентация на тему Палладий  Природные источники углеводородов
Природные источники углеводородов Аргументы к апелляции на ЕГЭ по химии 2021
Аргументы к апелляции на ЕГЭ по химии 2021 Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой Аналитическая химия. Введение
Аналитическая химия. Введение Презентация на тему Использование информационных технологий на уроках химии
Презентация на тему Использование информационных технологий на уроках химии  Классификация нефтей. Основы переработки нефти и нефтепродуктов
Классификация нефтей. Основы переработки нефти и нефтепродуктов Физическое явление в химии
Физическое явление в химии Презентация на тему Характеристика щелочных металлов 9 класс
Презентация на тему Характеристика щелочных металлов 9 класс  Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення
Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення Презентация на тему Законы электролиза
Презентация на тему Законы электролиза  Презентация на тему Азотная кислота
Презентация на тему Азотная кислота  Лекарственные средства – производные пиримидин 2,4,6-триона
Лекарственные средства – производные пиримидин 2,4,6-триона относительная атомная масса
относительная атомная масса Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия День химии
День химии Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс
Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс Презентация на тему Каучук
Презентация на тему Каучук  Химический Пентагон. Интеллектуальная игра для учащихся 10-11 классов
Химический Пентагон. Интеллектуальная игра для учащихся 10-11 классов Химическая замена
Химическая замена Основания, их состав и название
Основания, их состав и название Основные классы неорганических соединений
Основные классы неорганических соединений Сложные неорганические вещества
Сложные неорганические вещества Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Кислоты. Тест
Кислоты. Тест Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип
Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип Презентация на тему Графен - материал будущего
Презентация на тему Графен - материал будущего