Содержание
- 2. ОГЛАВЛЕНИЕ: 1. Гомологический ряд, номенклатура 2. Строение. Изомерия 3. Реакционноспособность 4. Химические свойства 5. Способы получения
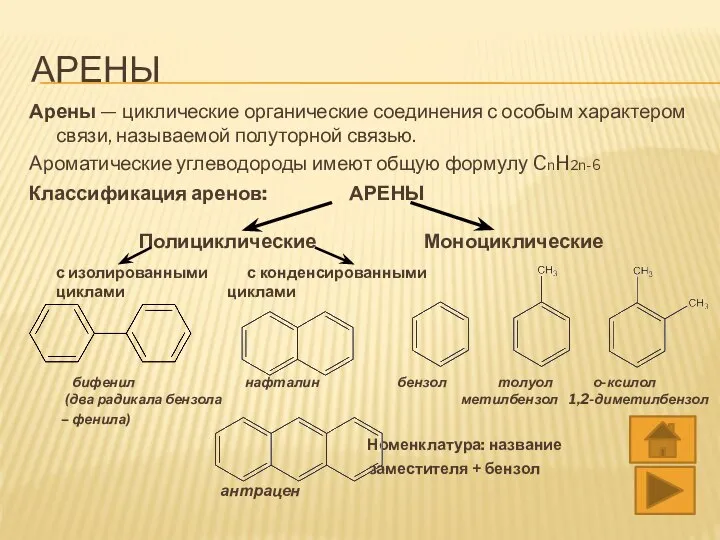
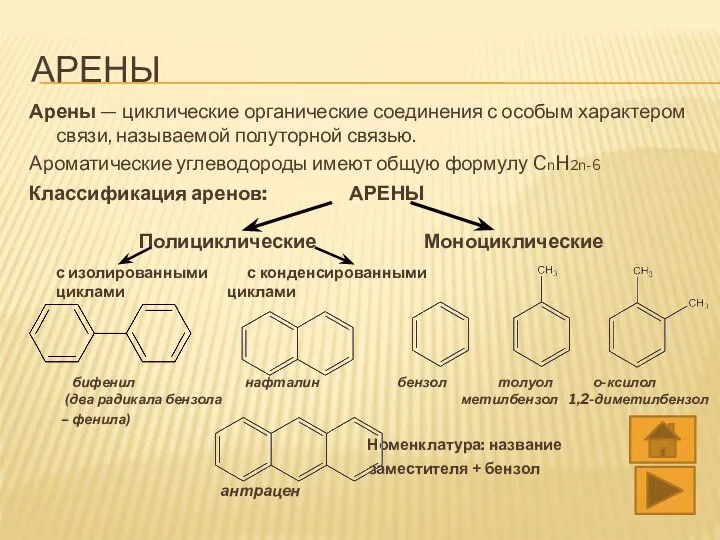
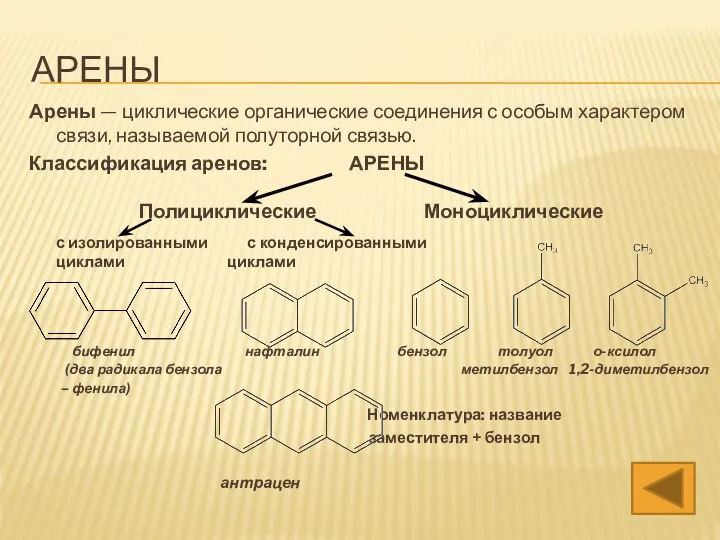
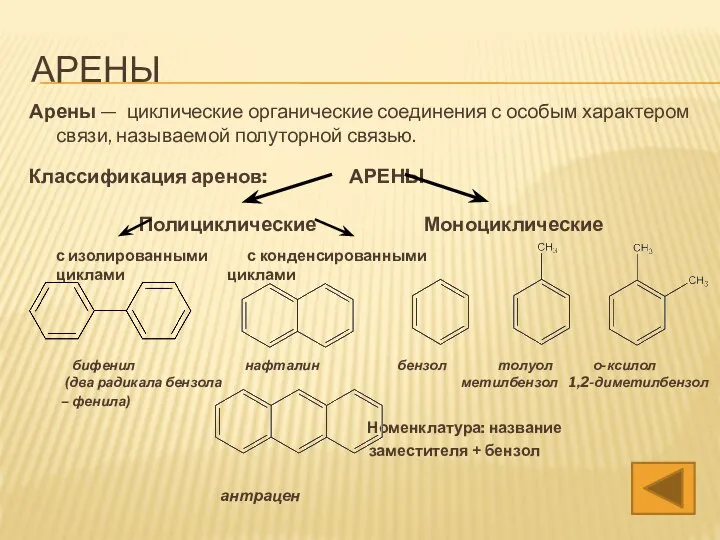
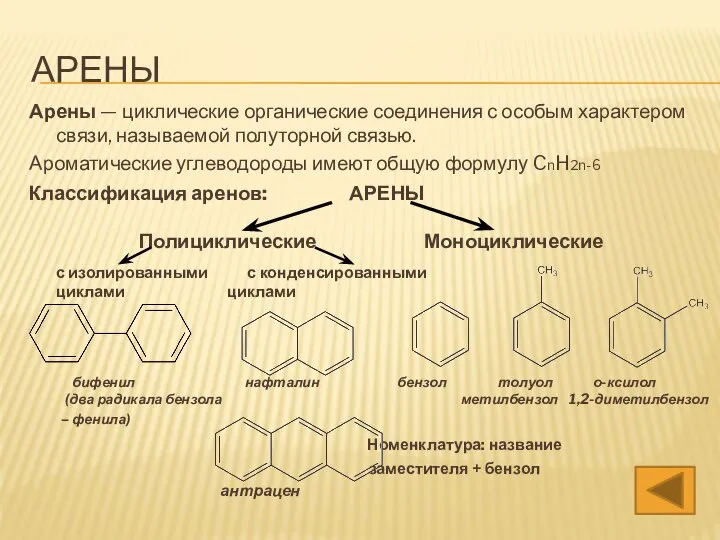
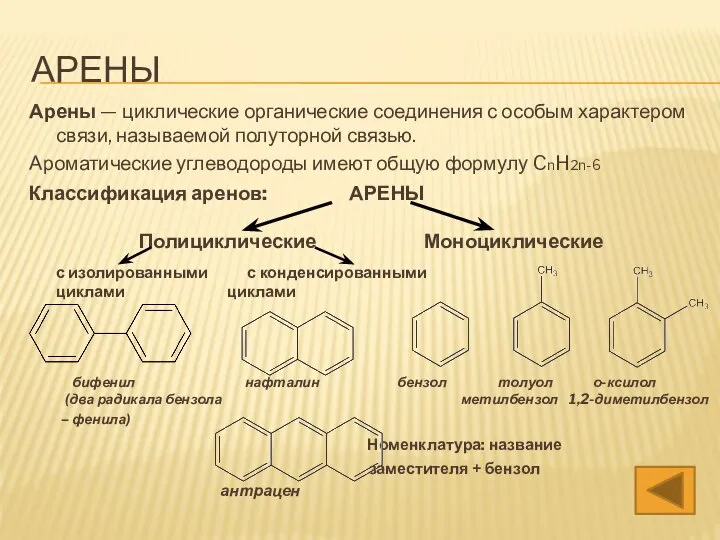
- 3. АРЕНЫ Арены — циклические органические соединения с особым характером связи, называемой полуторной связью. Ароматические углеводороды имеют
- 4. АРЕНЫ Арены — циклические органические соединения с особым характером связи, называемой полуторной связью. Ароматические углеводороды имеют
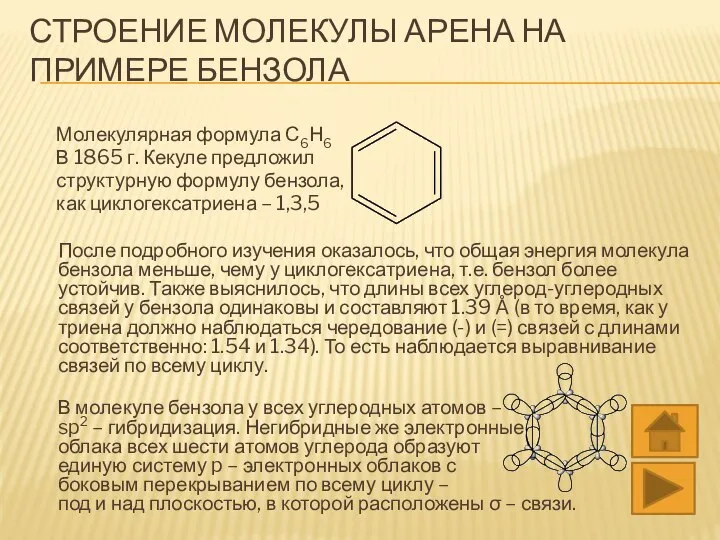
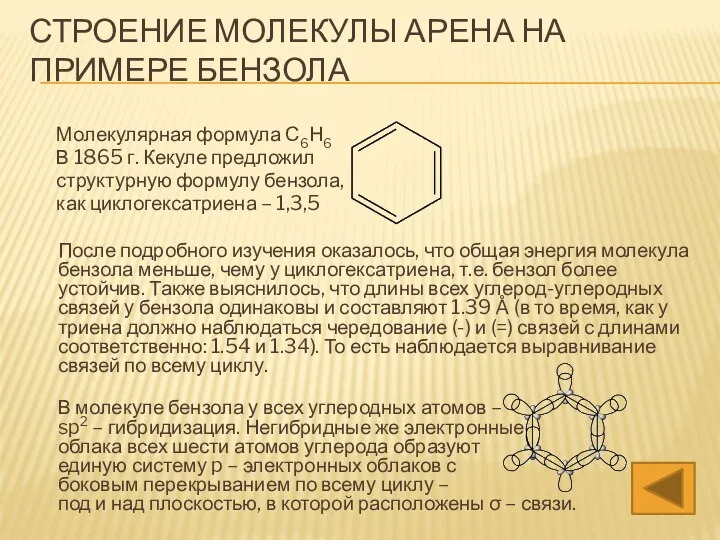
- 5. СТРОЕНИЕ МОЛЕКУЛЫ АРЕНА НА ПРИМЕРЕ БЕНЗОЛА Молекулярная формула С6Н6 В 1865 г. Кекуле предложил структурную формулу
- 6. Термин «полуторная связь» можно объяснить следующим образом: В цикле бензола присутствует полноценная σ – связь между
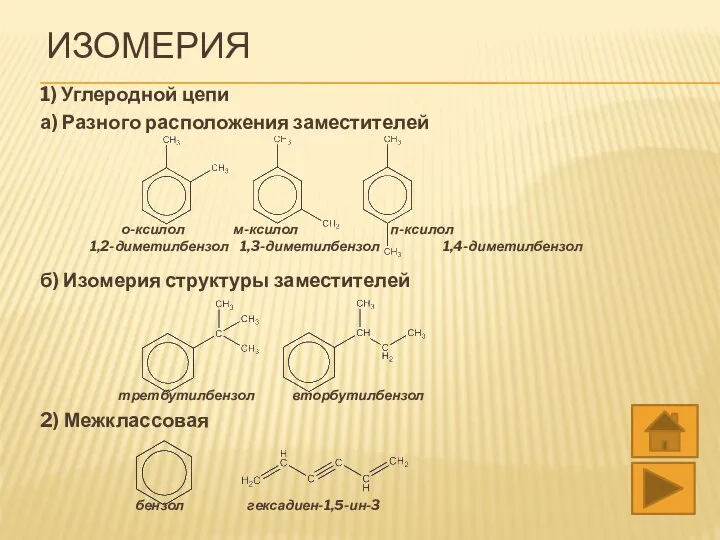
- 7. ИЗОМЕРИЯ 1) Углеродной цепи а) Разного расположения заместителей о-ксилол м-ксилол п-ксилол 1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол б) Изомерия
- 8. РЕАКЦИОННОСПОСОБНОСТЬ 1) Структура полуторной связи представляет собой замкнутую устойчивую шестиэлектронную шестицентровую систему, которая приводит к стабильности
- 9. ОРИЕНТАЦИЯ В БЕНЗОЛЬНОМ ЯДРЕ При появлении в бензольном ядре какого-либо заместителя внедрение дальнейших заместителей становится ориентированным
- 10. При их появлении в ядре электронная плотность смещается следующим образом: У группы ОН - J эф.
- 11. 2. Заместители второго рода. Все электронноакцепторные группы, т.е. те, которые содержат (=), ( ), (+). Они
- 12. ОСОБЕННОСТИ ГОМОЛОГОВ БЕНЗОЛА Взаимное влияние атомов в молекуле I. Влияние группы –СН3 на бензольное ядро. Орто-пара-активирующее
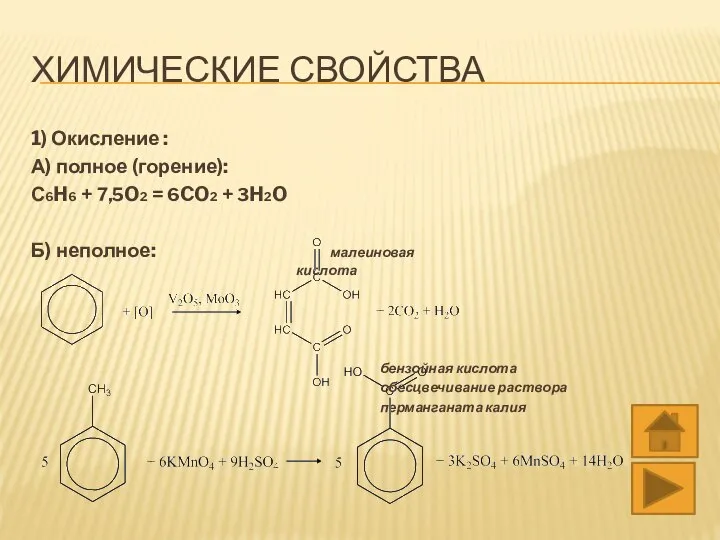
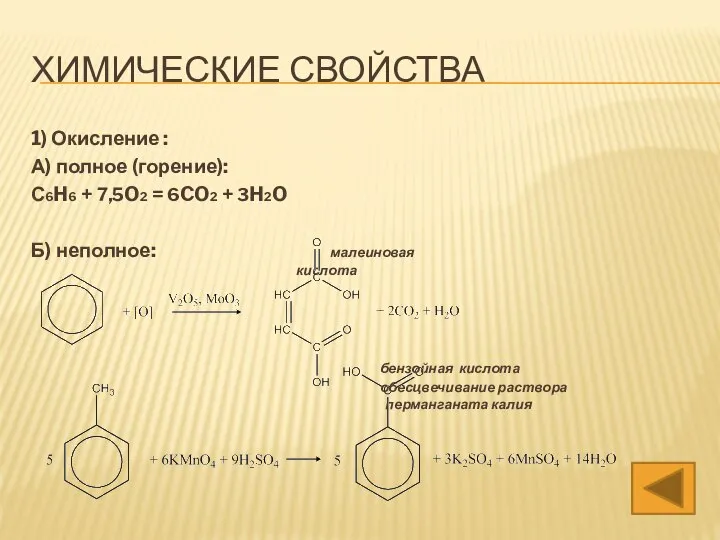
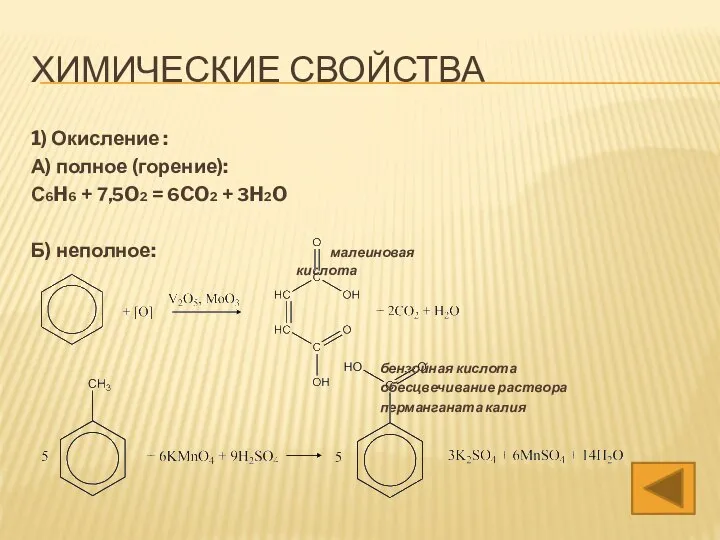
- 13. ХИМИЧЕСКИЕ СВОЙСТВА 1) Окисление : А) полное (горение): С6H6 + 7,5O2 = 6CO2 + 3H2O Б)
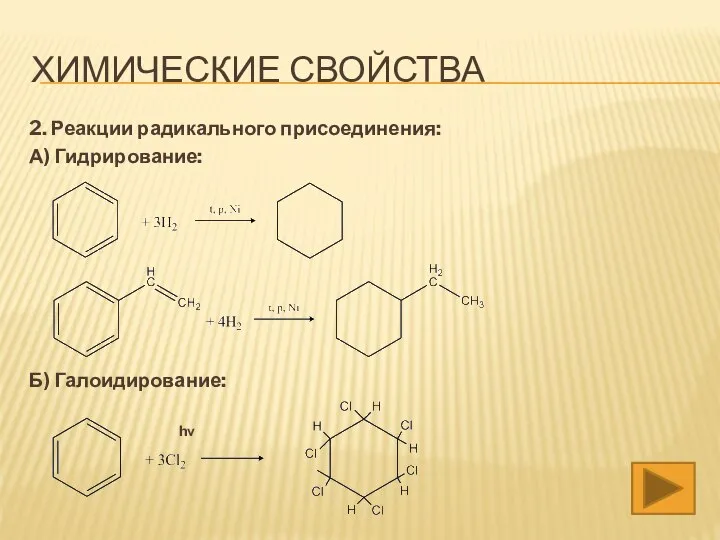
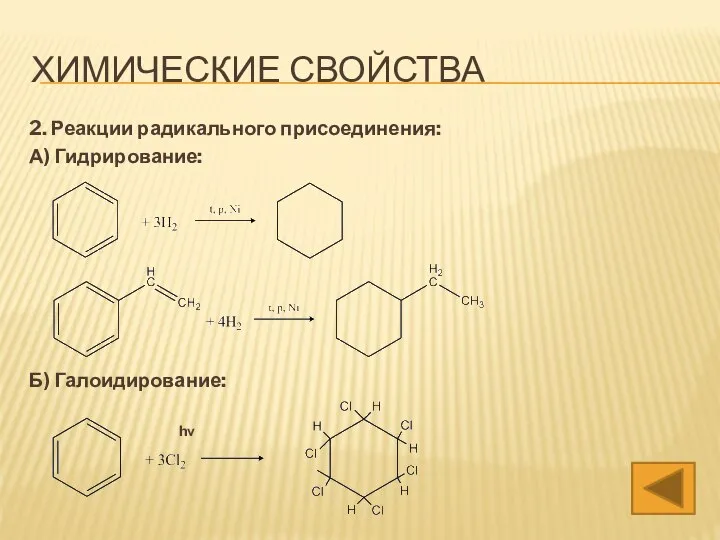
- 14. 2. Реакции радикального присоединения: А) Гидрирование: Б) Галоидирование: hν ХИМИЧЕСКИЕ СВОЙСТВА
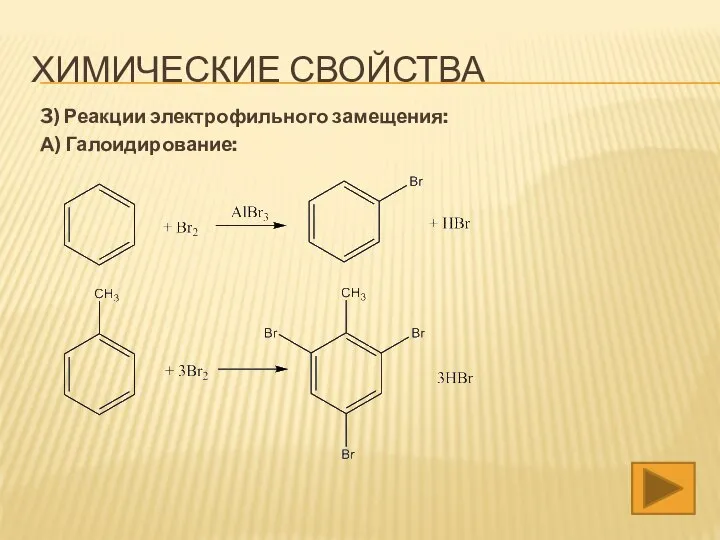
- 15. 3) Реакции электрофильного замещения: А) Галоидирование: ХИМИЧЕСКИЕ СВОЙСТВА
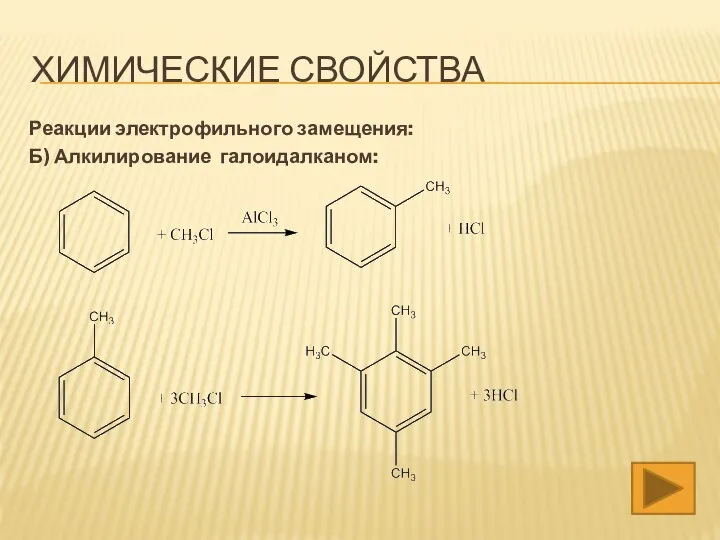
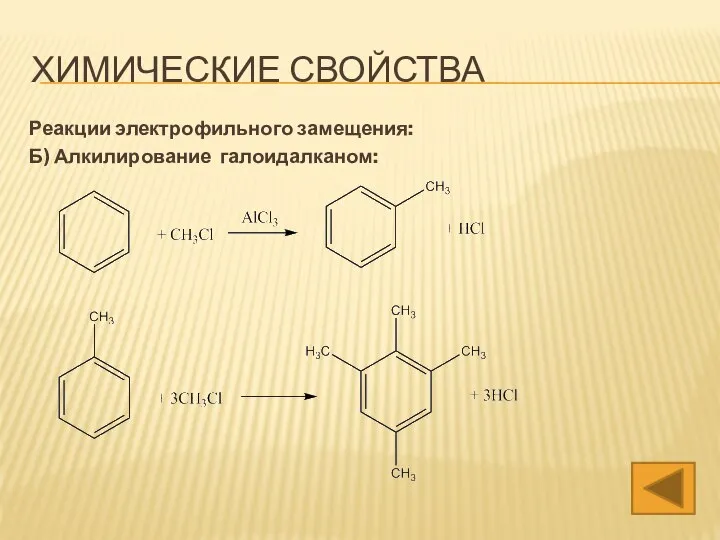
- 16. ХИМИЧЕСКИЕ СВОЙСТВА Реакции электрофильного замещения: Б) Алкилирование галоидалканом:
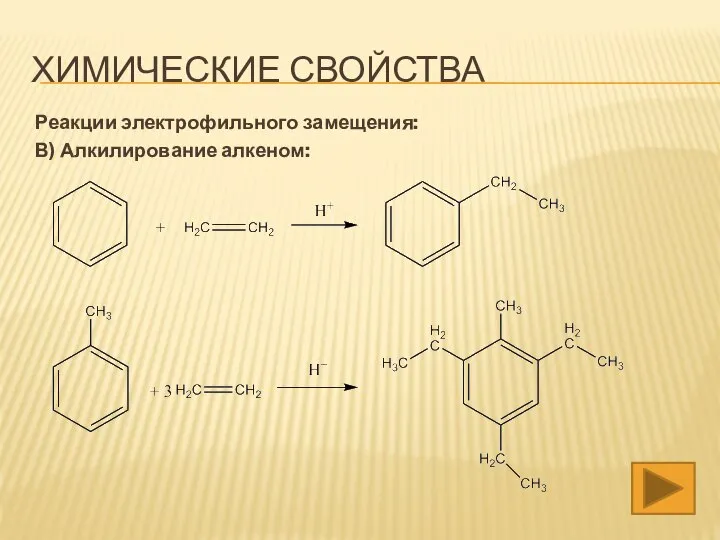
- 17. ХИМИЧЕСКИЕ СВОЙСТВА Реакции электрофильного замещения: В) Алкилирование алкеном:
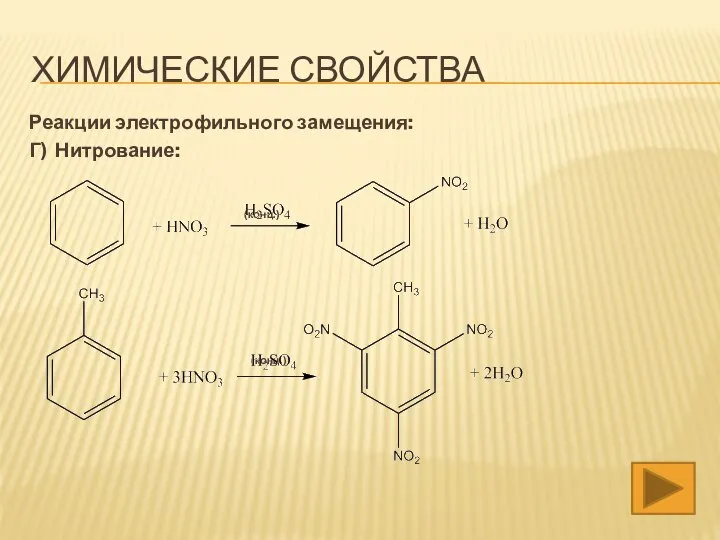
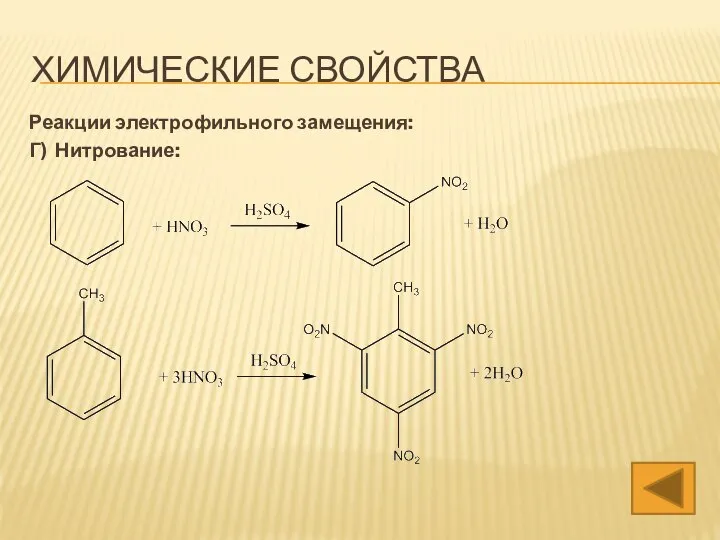
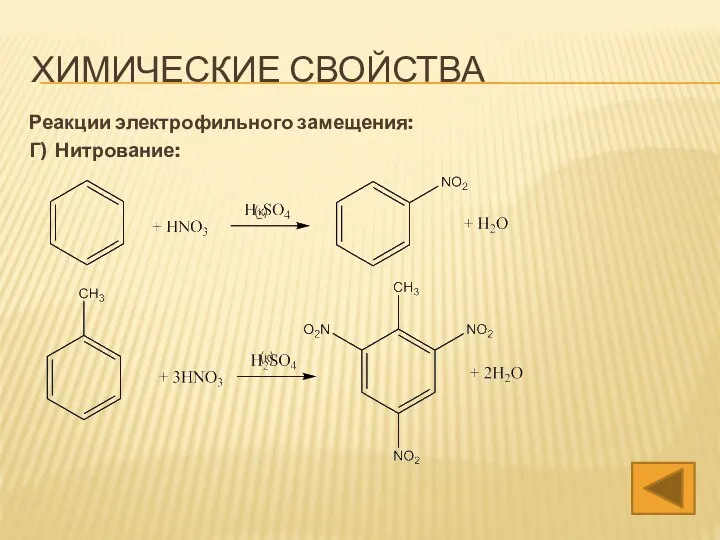
- 18. ХИМИЧЕСКИЕ СВОЙСТВА Реакции электрофильного замещения: Г) Нитрование: (конц.) (конц.)
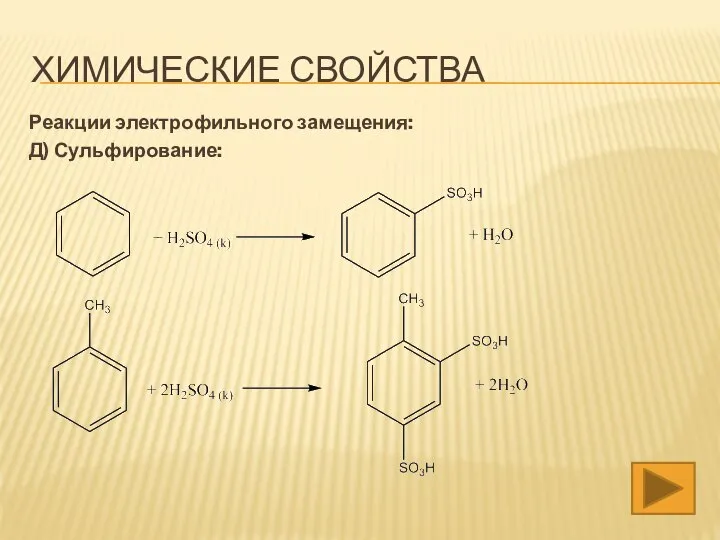
- 19. ХИМИЧЕСКИЕ СВОЙСТВА Реакции электрофильного замещения: Д) Сульфирование:
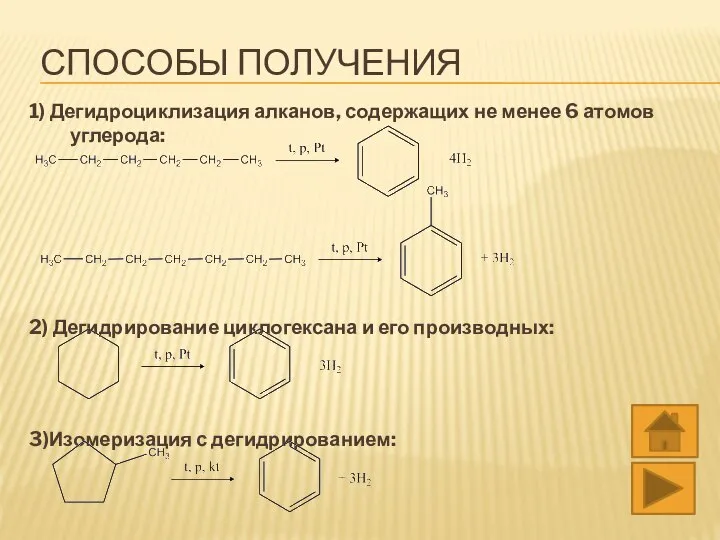
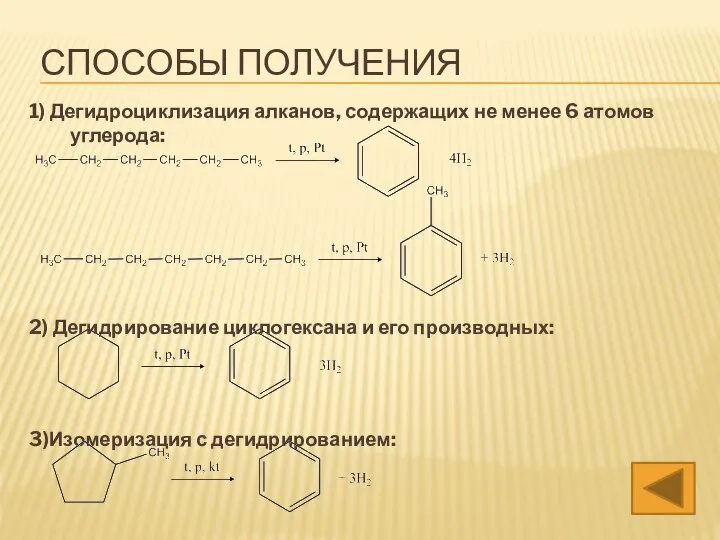
- 20. СПОСОБЫ ПОЛУЧЕНИЯ 1) Дегидроциклизация алканов, содержащих не менее 6 атомов углерода: 2) Дегидрирование циклогексана и его
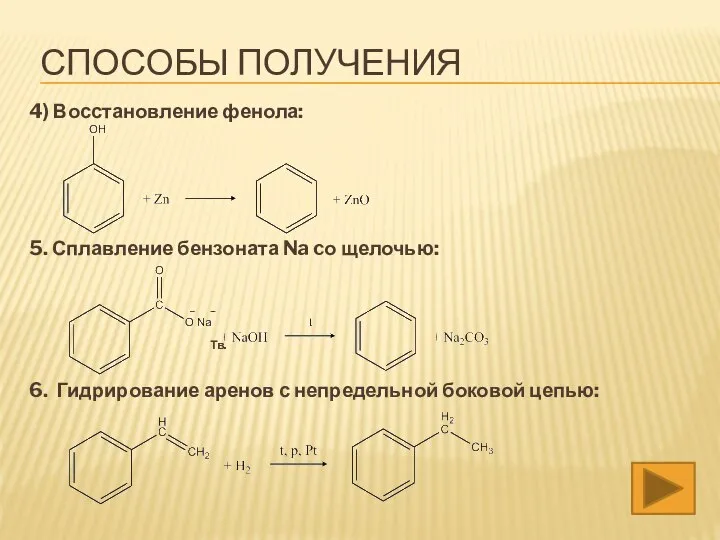
- 21. 4) Восстановление фенола: 5. Сплавление бензоната Na cо щелочью: Тв. 6. Гидрирование аренов с непредельной боковой
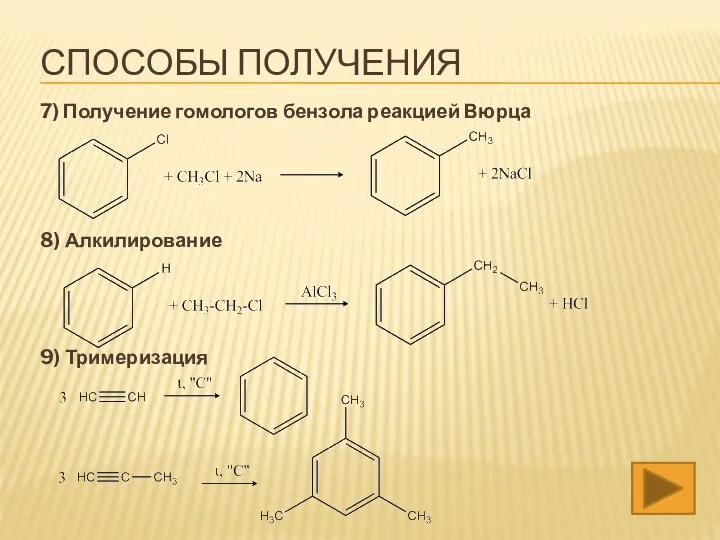
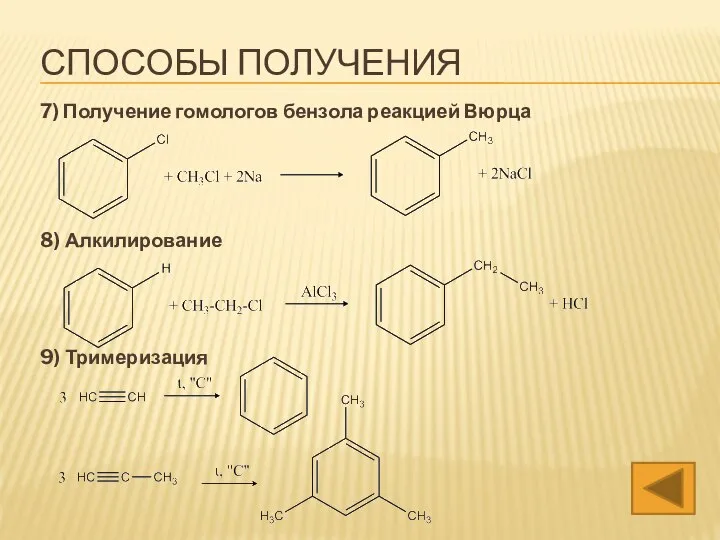
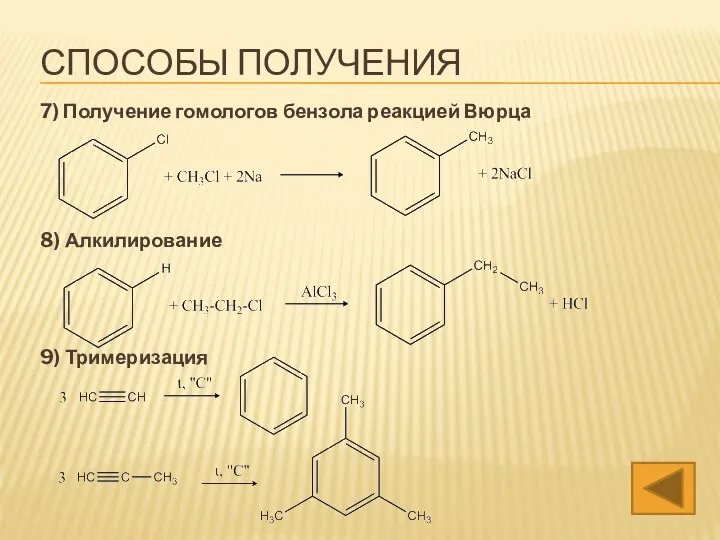
- 22. 7) Получение гомологов бензола реакцией Вюрца 8) Алкилирование 9) Тримеризация СПОСОБЫ ПОЛУЧЕНИЯ
- 23. БЕНЗОЛ C6H6 Описание: Бесцветная жидкость со специфическим сладковатым запахом. Простейший ароматический углеводород. Бензол входит в состав
- 24. ТОЛУОЛ C₇H₈ Описание: Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в
- 25. ДИФЕНИЛ C12H10 Описание: Бесцветные или белые кристаллы, со специфическим запахом. Не растворим в воде, растворим в
- 26. СТИРОЛ (ВИНИЛБЕНЗОЛ) C8H8 Описание: Бесцветная жидкость со специфическим запахом. Стирол практически нерастворим в воде, хорошо растворим
- 27. НАФТАЛИН С10Н8 Описание: Твердое кристаллическое вещество с характерным запахом. В воде не растворяется, но хорошо растворим
- 28. АНТРАЦЕН С14Н10 Описание: Бесцветные кристаллы, tпл 218° C. Нерастворим в воде, растворим в ацетонитриле и ацетоне,
- 29. ПРОВЕРКА ЗНАНИЙ В следующем разделе нашего учебника Вы сможете проверить свои знания. При выборе ответа на
- 30. ФОРМУЛА ВЕЩЕСТВА, ДЛЯ КОТОРОГО ХАРАКТЕРНА РЕАКЦИЯ ГИДРИРОВАНИЯ: 1. С3Н8 2. С6Н6 3. С6Н14 4. С4Н10
- 31. 2. Реакции радикального присоединения: А) Гидрирование: Б) Галоидирование: hν ХИМИЧЕСКИЕ СВОЙСТВА
- 32. АГРЕГАТНОЕ СОСТОЯНИЕ БЕНЗОЛА: 1. Газообразное 2. Твердое 3. Жидкое 4. Зависит от способа получения
- 33. БЕНЗОЛ C6H6 Описание: Бесцветная жидкость со специфическим сладковатым запахом. Простейший ароматический углеводород. Бензол входит в состав
- 34. РАДИКАЛ – С6Н5 НАЗЫВАЮТ: 1. Бензилом 2. Фенилом 3. Гексилом 4. Винилом
- 35. АРЕНЫ Арены — циклические органические соединения с особым характером связи, называемой полуторной связью. Классификация аренов: АРЕНЫ
- 36. ПРОДУКТОМ ТРИМЕРИЗАЦИИ АЦЕТИЛЕНА ЯВЛЯЕТСЯ: 1. Толуол 2. Ксилол 3. Метилбензол 4. Бензол
- 37. 7) Получение гомологов бензола реакцией Вюрца 8) Алкилирование 9) Тримеризация СПОСОБЫ ПОЛУЧЕНИЯ
- 38. НИТРОБЕНЗОЛ ПОЛУЧАЮТ ИЗ БЕНЗОЛА ПРИ ПОМОЩИ РЕАКЦИИ: 1. Электрофильного замещения 2. Нуклеофильного замещения 3. Отщепления 4.
- 39. ХИМИЧЕСКИЕ СВОЙСТВА Реакции электрофильного замещения: Г) Нитрование:
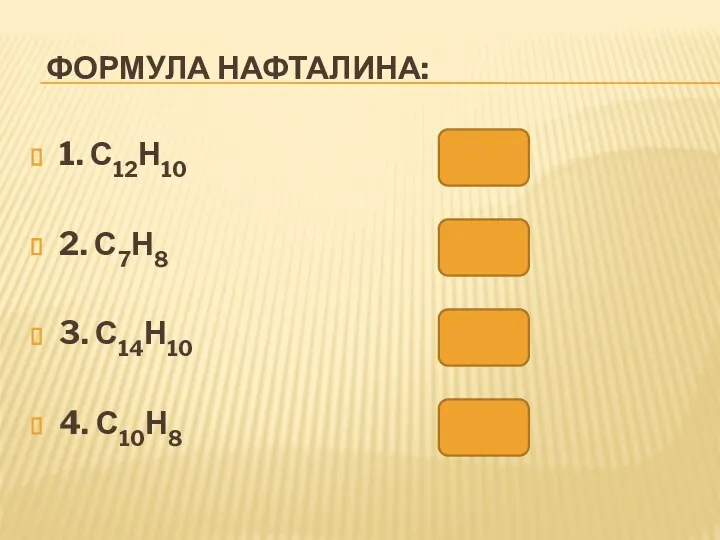
- 40. ФОРМУЛА НАФТАЛИНА: 1. С12Н10 2. С7Н8 3. С14Н10 4. С10Н8
- 41. НАФТАЛИН С10Н8 Описание: Твердое кристаллическое вещество с характерным запахом. В воде не растворяется, но хорошо растворим
- 42. К КЛАССУ АРЕНОВ ОТНОСЯТСЯ: 1. Метилциклогексан и толуол 2. Гептен и гексен. 3. Антрацен и нафталин
- 43. АРЕНЫ Арены — циклические органические соединения с особым характером связи, называемой полуторной связью. Классификация аренов: АРЕНЫ
- 44. БЕНЗОЛ ПОЛУЧАЮТ ДЕГИДРИРОВАНИЕМ: 1. Циклопентана 2. Метилциклобутана 3. Циклопентена 4. Циклогексана
- 45. СПОСОБЫ ПОЛУЧЕНИЯ 1) Дегидроциклизация алканов, содержащих не менее 6 атомов углерода: 2) Дегидрирование циклогексана и его
- 46. ФОРМУЛА КАТАЛИЗАТОРА В РЕАКЦИИ НИТРОВАНИЯ БЕНЗОЛА: 1. H2SO4 (конц) 2. AlCl3 3. HgSO4(р-р) 4. Pt
- 47. ХИМИЧЕСКИЕ СВОЙСТВА Реакции электрофильного замещения: Г) Нитрование: (к) (к)
- 48. УКАЖИТЕ ВЕЩЕСТВО X В СХЕМЕ ПРЕВРАЩЕНИЙ: МЕТАН —> X —> БЕНЗОЛ 1. Гексан 2. Ацетилен 3.
- 49. 7) Получение гомологов бензола реакцией Вюрца 8) Алкилирование 9) Тримеризация СПОСОБЫ ПОЛУЧЕНИЯ
- 50. НЕ ОБЕСЦВЕЧИВАЕТ РАСТВОР ПЕРМАНГАНАТА КАЛИЯ ПРИ НАГРЕВАНИИ ИЛИ ПРИ ПОДКИСЛЕНИИ: 1. Бензол 2. Пропилбензол 3. Изобутилбензол
- 51. ХИМИЧЕСКИЕ СВОЙСТВА 1) Окисление : А) полное (горение): С6H6 + 7,5O2 = 6CO2 + 3H2O Б)
- 52. МОНОМЕРОМ ПОЛИСТИРОЛА ЯВЛЯЕТСЯ: 1. Этилбензол 2. Винилбензол 3. Пропилбензол 4. Ксилол
- 53. СТИРОЛ (ВИНИЛБЕНЗОЛ) C8H8 Описание: Бесцветная жидкость со специфическим запахом. Стирол практически нерастворим в воде, хорошо растворим
- 54. АТОМ УГЛЕРОДА В БЕНЗОЛЬНОМ КОЛЬЦЕ НАХОДИТСЯ В СОСТОЯНИИ ГИБРИДИЗАЦИИ: 1. sp3d2 2. sp 3. sp2 4.
- 55. СТРОЕНИЕ МОЛЕКУЛЫ АРЕНА НА ПРИМЕРЕ БЕНЗОЛА Молекулярная формула С6Н6 В 1865 г. Кекуле предложил структурную формулу
- 56. ВЕЩЕСТВА, ИМЕЮЩИЕ ФОРМУЛЫ С6Н6 И С6Н14 , ЯВЛЯЮТСЯ: 1. Изомерами 2. Гомологами 3. Одним и тем
- 57. АРЕНЫ Арены — циклические органические соединения с особым характером связи, называемой полуторной связью. Ароматические углеводороды имеют
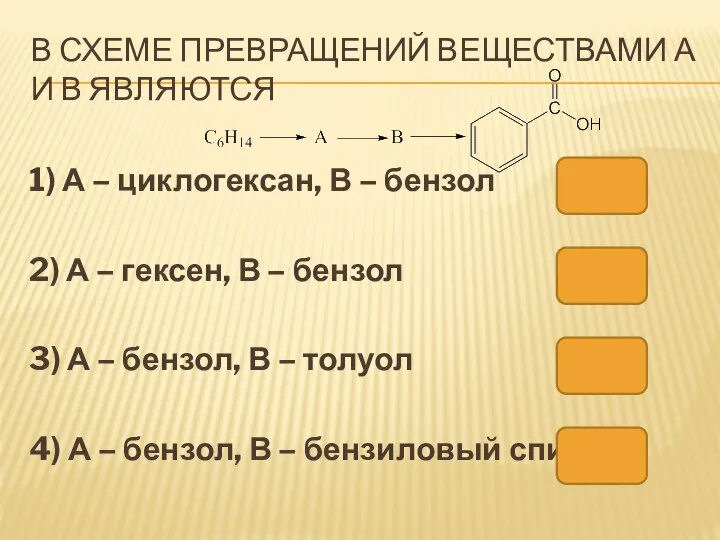
- 58. В СХЕМЕ ПРЕВРАЩЕНИЙ ВЕЩЕСТВАМИ А И В ЯВЛЯЮТСЯ 1) А – циклогексан, В – бензол 2)
- 59. ХИМИЧЕСКИЕ СВОЙСТВА 1) Окисление : А) полное (горение): С6H6 + 7,5O2 = 6CO2 + 3H2O Б)
- 60. ЧЕМ ТОЛУОЛ ОТЛИЧАЕТСЯ ОТ БЕНЗОЛА? 1) Числом электронов в системе π-связей 2) Химической активностью в реакциях
- 61. ОРИЕНТАЦИЯ В БЕНЗОЛЬНОМ ЯДРЕ При появлении в бензольном ядре какого-либо заместителя внедрение дальнейших заместителей становится ориентированным
- 62. БЕНЗОЛ ВСТУПАЕТ В РЕАКЦИЮ С В-ВАМИ: 1) Хлорметаном и пропеном 2) Этаном и бромэтаном 3) Серной
- 63. ХИМИЧЕСКИЕ СВОЙСТВА Реакции электрофильного замещения: Б) Алкилирование галоидалканом:
- 64. ЧИСЛО СИГМА-СВЯЗЕЙ В МОЛЕКУЛЕ О-КСИЛОЛА 1) 15 2) 20 3) 18 4) 21
- 65. АРЕНЫ Арены — циклические органические соединения с особым характером связи, называемой полуторной связью. Ароматические углеводороды имеют
- 66. Относительная плотность паров органического вещества по водороду равна 53. При сгорании 2,65 г этого вещества образуется
- 67. РЕШЕНИЕ №1 СxHyOz + O2 = CO2 + H2O 1) найдем молекулярную массу углеводорода M=D*M(H2)=53*2=106 2)
- 68. Сожгли 10,6 г о-ксилола. Полученный оксид углерода (IV) пропустили через 80 г раствора, содержащего в массовых
- 69. C8H10 + 10,5O2 = 8CO2 + 5H2O 1) Найдем количество вещества о-ксилола по формуле n =
- 70. Из 13,44 л ацетилена получили 12 г бензола (н.у.). Сколько это составляет процентов по сравнению с
- 71. 3C2H2 = C6H6 1) Найдем количество вещества ацетилена: n(C2H2) = V/Vm = 13,44 л/22,4 л =
- 72. Сколько по объему воздуха при нормальных условиях потребуется, чтобы сжечь 1 л бензола, плотность которого 0,88
- 73. C6H6 + 7,5O2 = 6CO2 + 3H2O 1) ρ = 0,88 г/см3 = 0,88 г/0,001 л
- 74. К 39 г бензола в присутствии бромида железа (III) добавили 1 моль брома. Какие вещества и
- 75. C6H6 + Br2 FeBr3 C6H5Br + HBr 1) Найдем количество вещества бензола по формуле n =
- 77. Скачать презентацию












































 Вебинар. Гидролиз солей
Вебинар. Гидролиз солей Препараты гормонов стероидной структуры
Препараты гормонов стероидной структуры Презентация на тему Строение атома и атомного ядра
Презентация на тему Строение атома и атомного ядра  Средства для борьбы с бытовыми насекомыми
Средства для борьбы с бытовыми насекомыми Физические явления. Способы разделения смесей
Физические явления. Способы разделения смесей Тренажер. Типы химических реакций
Тренажер. Типы химических реакций Алкены-3
Алкены-3 Металлы
Металлы Формулы оксидов
Формулы оксидов Валентность
Валентность Классификация химических реакций
Классификация химических реакций Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Сложные эфиры. Жиры
Сложные эфиры. Жиры Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Биопластик на основе лигнина
Биопластик на основе лигнина Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Химия и жизнь
Химия и жизнь Аминокилоты. Получение и применение
Аминокилоты. Получение и применение Періодична система хімічних елементів
Періодична система хімічних елементів Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии
Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии  Органическая химия. Теория строения органических соединений
Органическая химия. Теория строения органических соединений Лабораторное оборудование, посуда и средства защиты
Лабораторное оборудование, посуда и средства защиты Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Химические свойства металлов
Химические свойства металлов Тяжелосредные гидроциклоны
Тяжелосредные гидроциклоны Химические свойства металлов
Химические свойства металлов Микропластик в окружающей среде
Микропластик в окружающей среде