Содержание
- 2. Я, Кузьмина Ирина Викторовна, кандидат технических наук с большим опытом преподавания в высшей школе, обобщила полезную
- 3. Вернуться к содержанию Для выхода из программы нажмите «Esc» на клавиатуре Переход к тому действию, о
- 4. Содержание Практическая работа № 5 «Влияние температуры на скорость реакции». Практическая работа № 6 «Реакции обмена».
- 5. Практическая работа № 5 «Влияние температуры на скорость реакции»
- 6. Цель – Познакомиться с влиянием температуры на скорость реакции. Приборы и реактивы: химическая посуда, H2SO4, Zn,
- 7. Опыт 1. В два сосуда Ландольта опускаем по 3 гранулы цинка и добавляем раствор серной кислоты.
- 8. Прибор позволяет выявить влияние на скорость химической реакции следующих факторов: природы реагирующих веществ; концентрации; площади соприкосновения
- 9. Принцип работы прибора состоит во взаимодействии твердой фазы (гранул цинка) и жидкой (раствора кислоты) в сосудах
- 10. Прибор состоит из двух сосудов Ландольта (1), связанных с поворотным устройством (2), двух силиконовых трубок (3)
- 11. Опыт 2. В три стакана наливаем раствор серной кислоты, в 3 другие – раствор тиосульфата натрия.
- 12. H2SO4 + Na2S2O3 → Na2SO4 + H2SO3S +6 –2 +4 0 H2SO3S → H2SO3 + S↓
- 13. Практическая работа № 6 «Реакции обмена»
- 14. Цель – Познакомиться с условиями протекания обменных реакций. Приборы и реактивы: химическая посуда, NaOH, KOH, H2SO4,
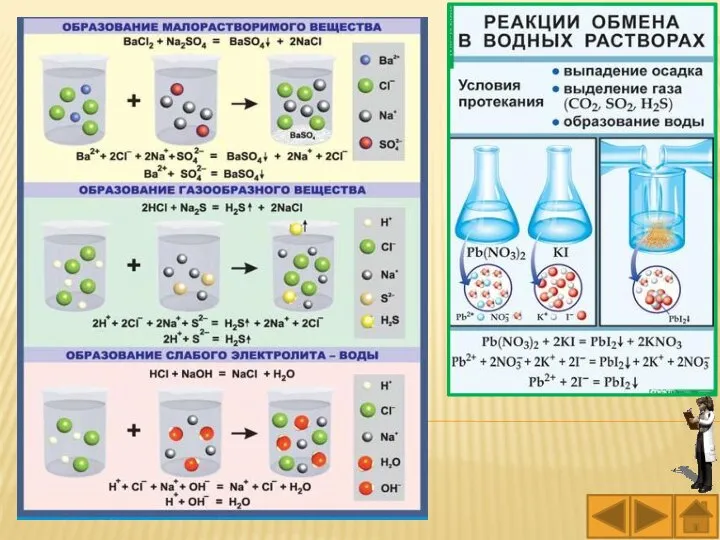
- 15. Обменные реакции в растворах электролитов протекают в направлении связывания ионов, в направлении образования более слабых электролитов,
- 18. Задание. Определите между какими парами веществ, приведенных в таблице, возможно химическое взаимодействие и почему? Напишите молекулярное,
- 19. Опыт 1. В пробирку внесите несколько капель раствора сульфата меди (II), а затем добавьте несколько капель
- 20. Аналогично оформите остальные опыты.
- 21. Гидролиз
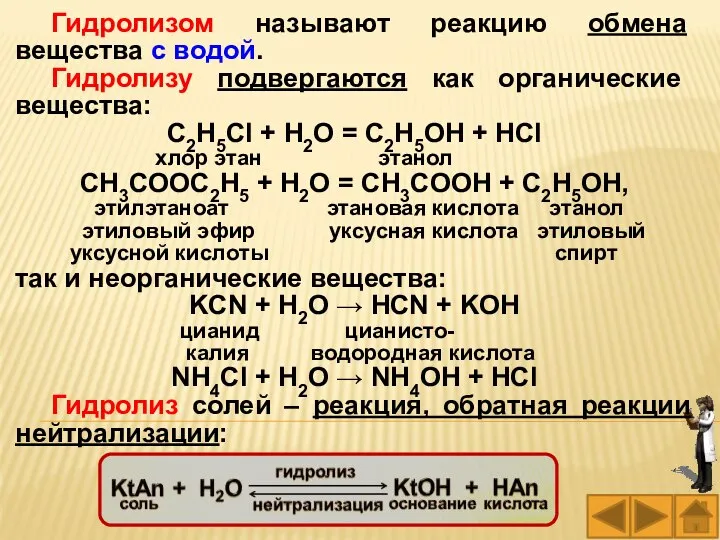
- 22. Гидролизом называют реакцию обмена вещества с водой. Гидролизу подвергаются как органические вещества: C2H5Cl + H2O =
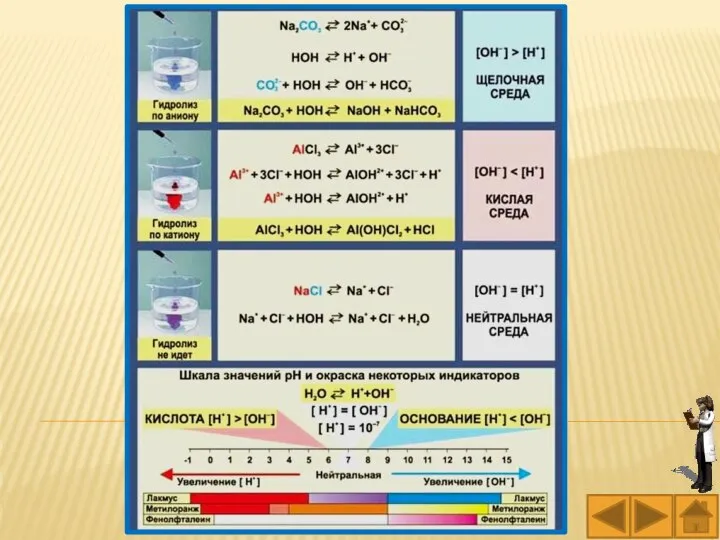
- 23. Гидролизу не подвергаются соли, образованные катионом сильного основания (Li+, Na+, K+, Rb+, Cs+, Ba2+, Sr2+, Ca2+
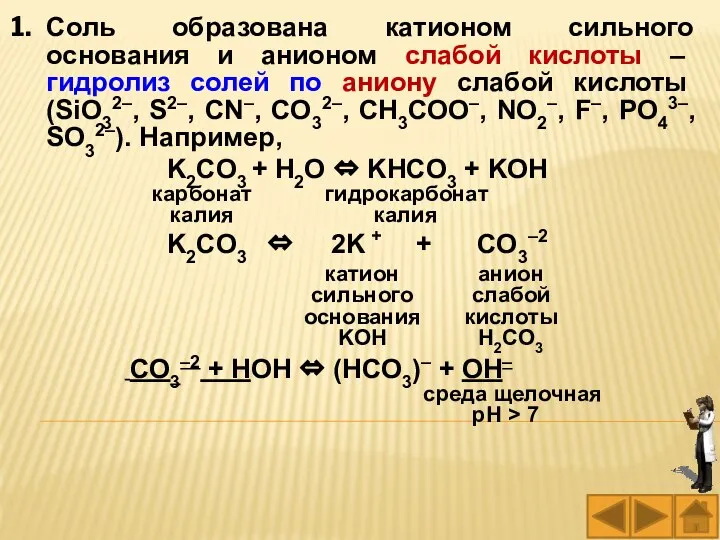
- 24. Соль образована катионом сильного основания и анионом слабой кислоты – гидролиз солей по аниону слабой кислоты
- 25. Гидролиз солей, образованных анионом слабой кислоты, усиливается (то есть равновесие смещается вправо) при: а) нагревании, так
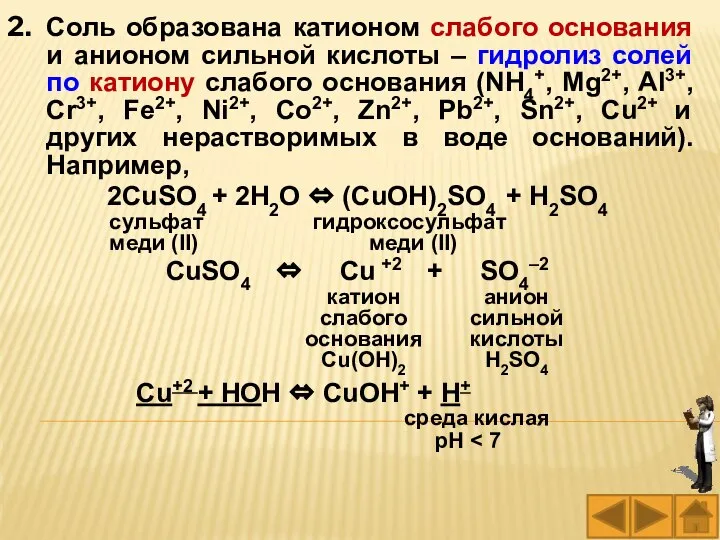
- 26. Соль образована катионом слабого основания и анионом сильной кислоты – гидролиз солей по катиону слабого основания
- 27. В растворе солей, гидролизующихся по катиону, среда кислая, pH Гидролиз таких солей усиливается при а) нагревании,
- 28. Соль образована катионом слабого основания и анионом слабой кислоты – гидролиз солей по катиону слабого основания
- 29. В растворе таких солей pH определяется силой образующихся кислоты и основания. В растворе ацетата аммония среда
- 30. Степень и константа гидролиза Степень гидролиза (h) – доля вещества, подвергшаяся гидролизу (отношение числа молекул, подвергшихся
- 31. Степень гидролиза зависит от: константы диссоциации образующегося слабого электролита (чем слабее образующиеся кислота и/или основание, тем
- 32. Константа гидролиза – константа равновесия обратимого процесса гидролиза: KF + H2O ⇔ HF + KOH F
- 33. HF – слабая кислота, диссоциирует обратимо: HF ⇔ H+ + F –. Подставляя эту величину в
- 34. Константа гидролиза зависит от природы соли и от температуры, но не зависит от концентрации соли. Для
- 35. Для солей, гидролизующихся и по катиону, и по аниону Чем слабее образующиеся кислота и/или основание, то
- 39. Практическая работа № 7 «Гидролиз солей»
- 40. Цель – Познакомиться с условиями протекания реакций гидролиза. Приборы и реактивы: химическая посуда, AlCl3, Na2CO3, KI,
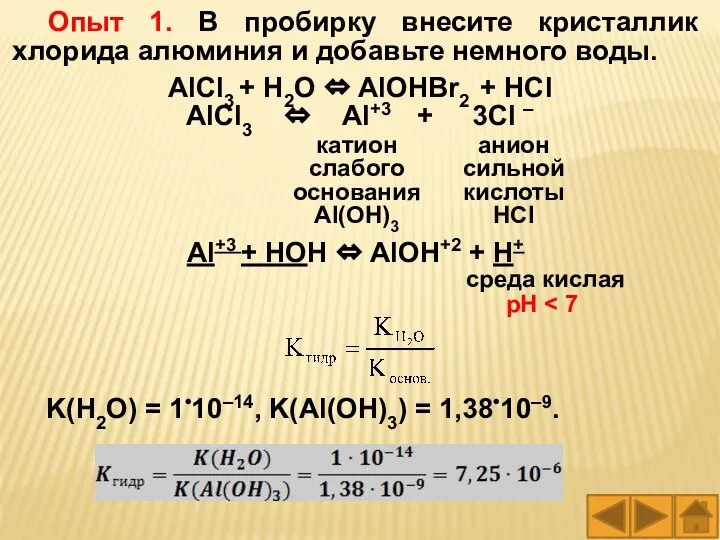
- 41. Опыт 1. В пробирку внесите кристаллик хлорида алюминия и добавьте немного воды. АlCl3 + H2O ⇔
- 42. Наблюдаемый эффект: с помощью универсаль-ного индикатора установили , что рН = 3. Константа гидролиза: Kгидр.(АlCl3) =
- 43. Практическая работа № 8 «Химическое равновесие в гомогенных системах»
- 44. Цель – Познакомиться с условиями смещения химического равновесия в гомогенных системах. Приборы и реактивы: химическая посуда,
- 45. Опыт 1. Влияние концентрации реагирующих веществ на химическое равновесие Для изучения влияния концентрации реагирующих веществ на
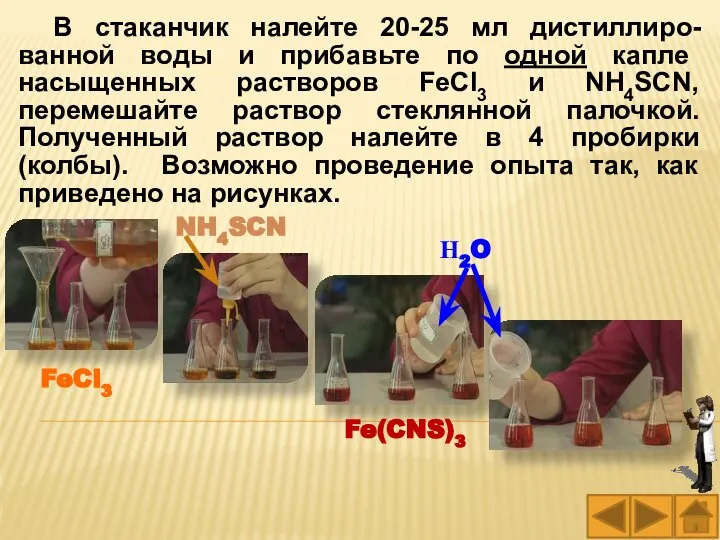
- 46. FeCl3 + 3NH4CNS ⇔ Fe(CNS)3 + 3NH4Cl. Из веществ этой системы Fe(CNS)3 интенсивно окрашен в красный
- 47. В стаканчик налейте 20-25 мл дистиллиро-ванной воды и прибавьте по одной капле насыщенных растворов FeCl3 и
- 48. Добавьте: в первую пробирку (колбу) одну каплю насыщенного раствора FeCl3, во вторую пробирку (колбу) одну каплю
- 49. Результаты эксперимента FeCl3 + 3NH4CNS ⇔ Fe(CNS)3 + 3NH4Cl 1 2 3 4
- 50. Направление смещение химического равновесия можно определить с помощью принципа Ле–Шателье: если на систему, находящуюся в равновесии,
- 51. Константа химического равновесия представляет собой дробь, в числителе которой стоит произведение равновесных концентраций (если реакция протекает
- 52. FeCl3 + 3NH4CNS ⇔ Fe(CNS)3 + 3NH4Cl В первую пробирку добавляли FeCl3 – окраска раствора усилилась,
- 53. Вывод: чтобы сместить химическое равновесие вправо, нужно увеличить концентрацию исходных веществ, а в лево – в
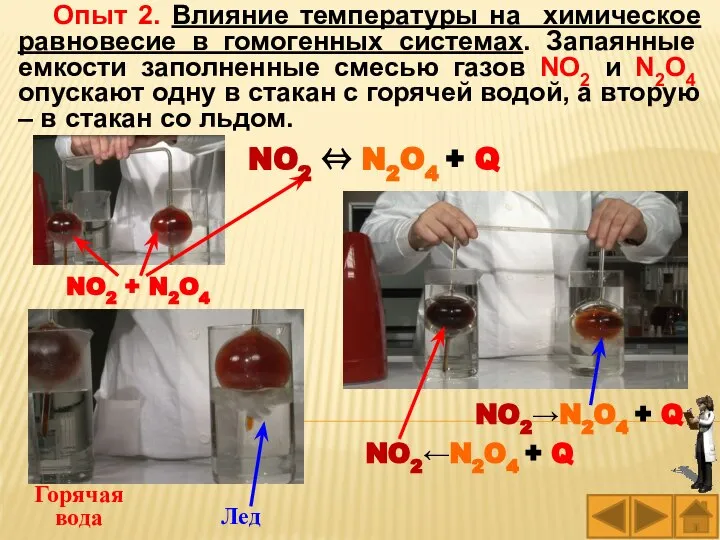
- 54. Опыт 2. Влияние температуры на химическое равновесие в гомогенных системах. Запаянные емкости заполненные смесью газов NO2
- 55. Реакция перехода оксида азота (IV) в димер этого оксида является экзотермической: NO2 ⇔ N2O4 + Q,
- 56. Практическая работа № 9 «Химическое равновесие в гетерогенных системах»
- 57. Цель – Познакомиться с условиями смещения химического равновесия в гетерогенных системах. Приборы и реактивы: химическая посуда,
- 58. Опыт 1. Влияние температуры на смещение химического равновесия. В растворе гидроксида аммония всегда соблюдается равновесие: NH3
- 59. В стакан с раствором гидроксида натрия добавляем фенолфталеин – раствор стал малиновым. NaOH NH4OH NaOH ⇔
- 60. Разольем полученные растворы в колбы.
- 61. При нагревании полученных растворов изменение окраски (обесцвечивание) происхо-дит в колбах с гидроксидом аммония – равновесие смещается
- 62. При охлаждении колбы с раствором гидроксида аммония окраска постепенно восстанавливается – равновесие смещается в сторону образования
- 63. NH3 + H2O ⇔ NH4OH ⇔ NH4+ + OH– Экзотермическая реакция Эндотермическая реакция Вывод: для увеличения
- 64. Ивчатов А. Л., Малов В. И. Химия воды и микробиология. – М.: ИНФРА-М, 2006. – 218
- 65. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ.
- 66. Химическое равновесие – Википедия ru.wikipedia.org› Химическое равновесие в растворах.wmv youtube.com video.yandex.ru›химическое равновесие ... опыты yandex.ru/images›химическое равновесие
- 68. Скачать презентацию






















































 Спирты. Классификация, изомерия
Спирты. Классификация, изомерия Электролитическая диссоциация веществ
Электролитическая диссоциация веществ Периодическая система Д. И. Менделеева. Знаки химических элементов
Периодическая система Д. И. Менделеева. Знаки химических элементов Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Классификация сложных неорганических веществ. Оксиды
Классификация сложных неорганических веществ. Оксиды Презентация на тему Стекло
Презентация на тему Стекло  Классификация органических соединений
Классификация органических соединений Магний (Mg)
Магний (Mg) Химия. Какой химический элемент преобладает в составе каменного угля? Тест
Химия. Какой химический элемент преобладает в составе каменного угля? Тест Вторичная переработка нефти. Риформинг
Вторичная переработка нефти. Риформинг Презентация на тему Химия и повседневная жизнь человека
Презентация на тему Химия и повседневная жизнь человека  Юные химики. Своя игра
Юные химики. Своя игра Решение задач на основные законы и понятия химии
Решение задач на основные законы и понятия химии Кислород
Кислород Харктеристика металлов
Харктеристика металлов География. Уральские самоцветы
География. Уральские самоцветы Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Применение коллоидных систем
Применение коллоидных систем Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных
Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных Алюміній. Фізичні та хімічні властивості
Алюміній. Фізичні та хімічні властивості Консерванты, их виды и применение
Консерванты, их виды и применение Сложные вещества кислоты
Сложные вещества кислоты Алкены
Алкены Уран гексафториді
Уран гексафториді Окисники, відновники
Окисники, відновники Теоретические основы аналитичесой химии. Общие понятия
Теоретические основы аналитичесой химии. Общие понятия Природные источники углеводородов
Природные источники углеводородов