Содержание
- 2. Сероводород. Сульфиды.
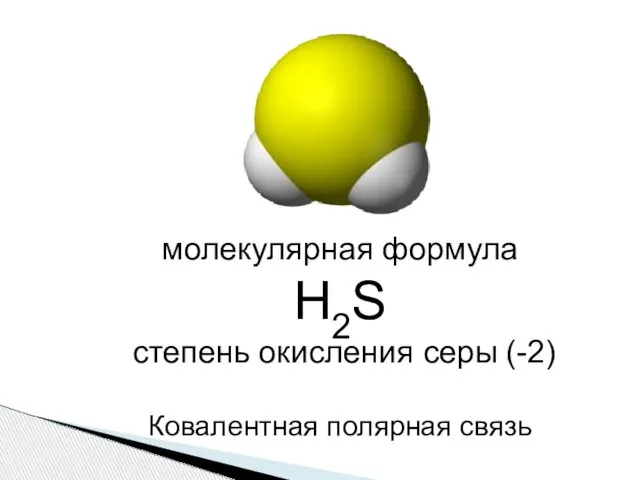
- 3. молекулярная формула Н2S степень окисления серы (-2) Ковалентная полярная связь
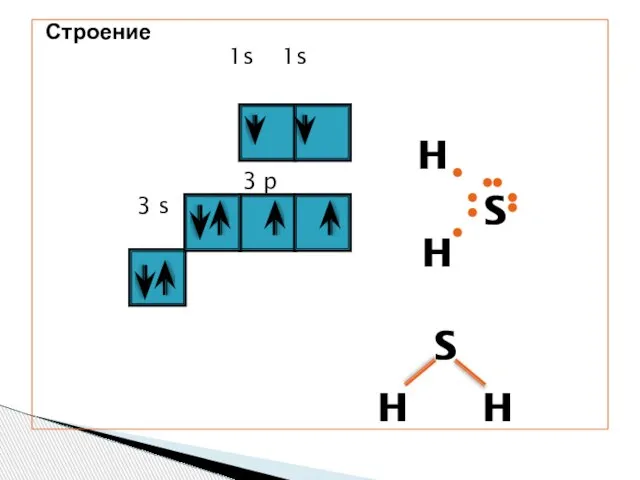
- 4. Строение 1s 1s 3 p 3 s H H S S H H
- 5. Молекула сероводорода имеет угловую форму, поэтому она полярна. В отличие от молекул воды, атомы водорода в
- 6. Нахождение в природе в свободном состоянии встречается в составе вулканических газов, во многих источниках вулканических местностей,
- 7. в растворенном и отчасти в свободном состоянии сероводород содержится в Черном море, начиная с глубины 200
- 8. в небольших количествах он образуется всюду, где происходит разложение или гниение органических веществ
- 9. в небольших количествах он образуется всюду, где происходит разложение или гниение органических веществ: она присутствует в
- 10. Д воздух -? М(Воздух)= 29 г/моль М(H2S)= 34 г/моль Д воздух = 34:29=1,17 Д воздух =1,17
- 11. Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да) 1. Бесцветный газ с запахом тухлых яиц и сладковатым вкусом. 2.
- 12. 1. В лаборатории сероводород получают взаимодействием сульфида железа с соляной или разбавленной серной кислотами: FeS +
- 13. 1 ступень H2S → H+ + HS- 2 ступень HS- ↔ H+ + S2- Диссоциация по
- 14. Взаимодействуют: - меняют окраску индикаторов -с основаниями -основными и амфотерными оксидами металлами солями Общие свойства кислот
- 15. H2S + NaOH → NaHS + H2O избыток H2S + 2NaOH → Na2S + 2H2O избыток
- 16. Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV) 2H2S-2 +
- 17. Сероводород обладает свойствами восстановителя: если в пробирку с сероводородом прилить небольшое количество йодной воды, то раствор
- 18. Влияние сероводорода на окружающую среду и здоровье человека Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает
- 19. Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются как
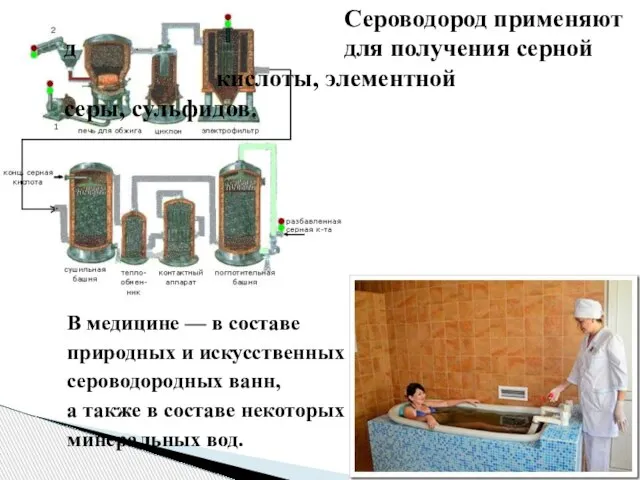
- 20. Сероводород применяют д для получения серной кислоты, элементной серы, сульфидов. В медицине — в составе природных
- 21. Сульфиды калия, стронция и бария используются в кожевенном деле для удаления шерсти со шкур перед их
- 23. Лабораторный опыт Pb(NO3)2 + Na2S → PbS↓ + 2NaNO3 осадок черного цвета (Na2S + CuCl2 →
- 25. Скачать презентацию



















 Неорганическая и органическая химия
Неорганическая и органическая химия Химические явления
Химические явления Строение и физические свойства металлов
Строение и физические свойства металлов Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Общая характеристика металлов
Общая характеристика металлов Prezentatsia_lektsia_Reaktora_2_Materialny_balans
Prezentatsia_lektsia_Reaktora_2_Materialny_balans Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс)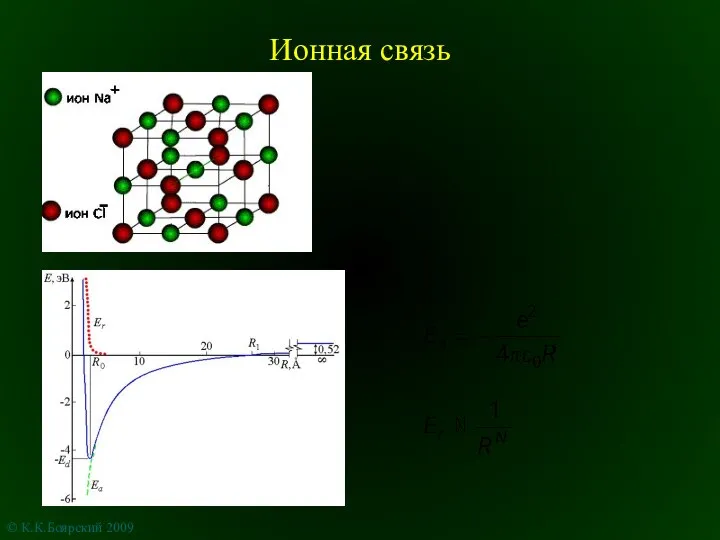 Ионная связь
Ионная связь Образовательные технологии, используемые на уроках химии для повышения мотивации обучения
Образовательные технологии, используемые на уроках химии для повышения мотивации обучения Что такое электрон?
Что такое электрон? Практическая работа 1. ХТП. Классификация химических реакций
Практическая работа 1. ХТП. Классификация химических реакций Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Презентация на тему Привычная и удивительная поваренная соль
Презентация на тему Привычная и удивительная поваренная соль  Презентация1
Презентация1 Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас) Спирты и их производные
Спирты и их производные Турнир смекалистых. Все о кислотах
Турнир смекалистых. Все о кислотах Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Классификация загрязняющих веществ по фазово-дисперсному составу
Классификация загрязняющих веществ по фазово-дисперсному составу ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Свойства воды
Свойства воды Массообменные процессы
Массообменные процессы Солевые кристаллы
Солевые кристаллы Оксиды. Физические свойства
Оксиды. Физические свойства Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота